stoikiometri
- 1. BAB 5 STOIKIOMETRI 5.1 Tata Nama Senyawa Sederhana 5.2 Hukum-hukum Dasar Kimia 5.3 Persamaan Reaksi 5.4 Hukum Gay Lussac dan Hipotesis Avogadro 5.5 Konsep Mol 5.6 Soikiometri Senyawa 5.7 Stoikiometri Reaksi
- 2. Tata Nama Senyawa Anorganik a. Senyawa Molekul (Senyawa Kovalen) Biner Senyawa biner adalah senyawa yang hanya terdiri dari dua jenis unsur, misalnya air (H2O), amonia (NH3), dan karbon dioksida (CO2). 1. Rumus Senyawa: unsur yang terdapat lebih dahulu dalam urutan berikut ditulis di depan. B ŌĆō Si ŌĆō C ŌĆō Sb ŌĆō As ŌĆō P ŌĆō N ŌĆō H ŌĆō S ŌĆō I ŌĆō Br ŌĆō Cl ŌĆō O ŌĆō F Contoh: Rumus kimia amonia lazim ditulis sebagai NH3 bukan H3N.
- 3. 2. Nama Senyawa: nama senyawa kovalen biner adalah rangkaian nama kedua jenis unsur dengan akhiran ida pada nama unsur yang kedua. Contoh: HCl : hidrogen klorida H2S : hidrogen sulfida Jika pasangan unsur membentuk lebih dari sejenis senyawa, maka dibedakan dengan menyebutkan angka indeks dalam bahasa Yunani. Contoh: CO : karbon monokdisa CO2 : karbon dioksida 3. Senyawa yang sudah umum dikenal tidak perlu mengikuti aturan di atas. Contoh: H2O : air CH4 : metana
- 4. Senyawa ion terdiri atas suatu kation dan suatu anion. 1. Rumus senyawa: kation ditulis di depan. Contoh: Rumus kimia natrium klorida ditulis NaCl, bukan ClNa. 2. Nama senyawa: nama senyawa ion adalah rangkaian nama kation (di depan), nama anioinnya, angka indeks tidak disebut. b. Tata Nama Senyawa Ion
- 5. Contoh: CaCl2 (kalsium klorida) Jika unsur logam mempunyai lebih dari sejenis bilangan oksidasi, senyawa-senyawanya dibedakan dengan menuliskan bilangan oksidasinya. Contoh: FeCl2 : besi (II) klorida FeCl3 : besi (III) klorida
- 6. c. Tata Nama Asam Asam adalah senyawa hidrogen yang di dalam air mempunyai rasa masam. Rumus kimia asam umumnya terdiri dari atom hidrogen dan suatu anion yang disebut sisa masam. Contoh: H3PO4 Nama asam: asam fosfat Rumus sisa asam: PO4 3ŌĆō
- 7. d. Tata Nama Basa Basa adalah senyawa ion dari suatu logam dengan ion hidroksida (OH). Tata nama basa sama dengan tata nama senyawa ion. Contoh: NaOH : natrium hidroksida (soda kaustik) Ca(OH)2: kalsium hidroksida (kapur sirih) Al(OH)3: alumunium hidroksida (dlm obat maag) Fe(OH)2: besi(II) hidroksida
- 8. Tata Nama Senyawa Organik Senyawa organik adalah senyawa-senyawa karbon dengan sifat-sifat tertentu. Berikut ini adalah nama lazim dari beberapa senyawa organik 1. CH4 : metana (gas rawa, gas alam, atau gas tambang) 2. CO(NH2)2 : urea (ureum) 3. CH3COOH : asam cuka (asam asetat) 4. C6H12O6 : glukosa (gula darah, gula anggur) 5. HCHO : formaldehida (bahan formalin) 6. CHCI : iodoform (suatu antiseptik) 7. CH3CH2OH : etanol (alkohol)
- 9. Hukum-Hukum Dasar Kimia Hukum Lavoiser (Hukum Kekekalan Massa) ŌĆó ŌĆ£Dalam sistem tertutup, massa zat sebelumnya dan sesudah reaksi adalah samaŌĆØ Hukum Proust (Hukum Perbandingan Tetap) ŌĆó ŌĆ£Perbandingan massa unsur-unsur dalam suatu senyawa adalah tertentu dan tetapŌĆØ Hukum Dalton (Hukum Kelipatan Berganda) ŌĆó ŌĆ£Hukum kelipatan berganda berkaitan dengan pasangan unsur yang dapat membentuk lebih dari satu jenis senyawaŌĆØ
- 10. Persamaan Reaksi ’é¦ Tanda panah menunjukkan arah reaksi. ’é¦ Huruf kecil miring dalam tanda kurung menyatakan wujud atau keadaan zat. ’é¦ Huruf g berarti gas,l berarti cairan atau (liquid), s berarti padat (solid), dan aq berarti larutan dalam air (aqueous) ’é¦ Bilangan yang mendahului rumus kimia zat dalam persamaan reaksi disebut koefisien reaksi. ’é¦ Persamaan reaksi yang sudah diberi koefisien yang sesuai disebut persamaan setara. 2H2(g) + O2(g) 2H2O(l)
- 11. Menuliskan Persamaan Reaksi Contoh: Alumunium bereaksi dengan larutan asam sulfat membentuk alumunium sulfat dan gas hidrogen. Langkah 1: menuliskan persamaan kata-kata Alumunium + larutan asam sulfat larutan alumunium sulfat + gas hidrogen Langkah 2: menuliskan persamaan rumus Al(s) + H2SO4 (aq) Al2(SO4)3(aq) + H2(g) (belum setara) Langkah 3: penyetaraan 2Al(s) + 3H2SO4(aq) Al2(SO4)3(aq) + 3H2(g) (setara)
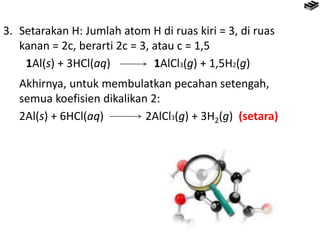
- 12. Menyetarakan Persamaan Reaksi Contoh: Al(s) + HCl (aq) AlCl3(g) (belum setara) 1. Tetapkan koefisien AlCl3 = 1, sedangkan zat lainnya dengan koefisien sementara . aAl(s) + bHCl(aq) 1AlCl3(g) + cH2(g) 2. Setarakan atom Al dan Cl Penyetaraan atom Al: Jumlah atom Al di ruas kiri = a, sedangkan di ruas kanan = 1, berarti a = 1. Penyetaraan atom Cl: Jumlah atom Cl di ruas kiri = b, sedangkan di ruas kanan = 3 berarti b = 3. 1Al(s) + 3HCl(aq) 1AlCl3(g) + cH2(g)
- 13. 3. Setarakan H: Jumlah atom H di ruas kiri = 3, di ruas kanan = 2c, berarti 2c = 3, atau c = 1,5 1Al(s) + 3HCl(aq) 1AlCl3(g) + 1,5H2(g) Akhirnya, untuk membulatkan pecahan setengah, semua koefisien dikalikan 2: 2Al(s) + 6HCl(aq) 2AlCl3(g) + 3H2(g) (setara)
- 14. Hukum Gay Lussac Contoh: Pada reaksi antara gas nitrogen dengan gas hidrogen membentuk amonia, perbandingan volumnya adalah 1 : 3 : 2. Gay Lussac menyimpulkan penemuannya dalam suatu perbandingan volum, yaitu: ŌĆ£Bila diukur pada suhu dan tekanan yang sama, volum gas yang bereaksi dan gas hasil reaksi berbanding sebagai bilangan bulat dan sederhanaŌĆØ
- 15. Hipotesis Avogadro Hukum Perbandingan Volum Avogadro: Jadi, perbandingan volum gas-gas itu juga merupakan perbandingan jumlah molekul yang terlibat dalam reaksi atau perbandingan volum gas-gas yang bereaksi sama dengan koefisien reaksinya. ŌĆ£Pada suhu dan tekanan sama, semua gas bervolum sama mengandung jumlah molekul yang sama pula.ŌĆØ
- 16. Contoh: Reaksi antara gas hidrogen dengan gas klorin membentuk gas hidrogen klorida. 1Hx(g) + 1Cly(g) 2HaClb(g) Nilai paling sederhana untuk x dan y yang membuat persamaan di atas setara adalah x = 2 dan y = 2. Dengan x = , maka nilai a = 1. Dengan y = 2, maka nilai b = 1. Jadi, persamaan di atas menjadi: H2(g) + Cl2(g) 2HCl(g)
- 17. Konsep Mol 1 mol = 6,02 x 10 (= 602 miliar triliun)23 Bilangan 6,02 x 10 ini disebut tetapan Avogadro dan dinyatakan dengan lambang L. L = 6,02 x 10 23 23 Hubungan jumlah mol (n) dengan jumlah partikel (Žć) Žć = n x 6,02 x 1023
- 18. Massa Molar (mm) m = n x mm 23 Contoh: Diketahui Ar Ca = 40 dan Mr CO2 = 44, maka - massa 1 mol Ca (= 6,02 x 10 atom Ca) = 40 gram. - massa 1 mol CO2 (= 6,02 x 10 molekul CO2) = 44 gram.23 Untuk unsur yang partikelnya berupa atom: mm = Ar gram mol Untuk zat lainnya : mm = Mr gram mol -1 -1 dengan m = massa n = jumlah mol mm = massa molar
- 19. Volum Molar Gas (Vm) V = n x Vm 23 Contoh: Diketahui Ar Ca = 40 dan Mr CO2 = 44, maka - massa 1 mol Ca (= 6,02 x 10 atom Ca) = 40 gram. - massa 1 mol CO2 (= 6,02 x 10 molekul CO2) = 44 gram.23 Pada keadaan STP : Vm = 22,4 liter mol Pada keadaan RTP : Vm = 24 liter mol -1 -1 Keterangan: V = volum n = jumlah mol Vm = volum molar
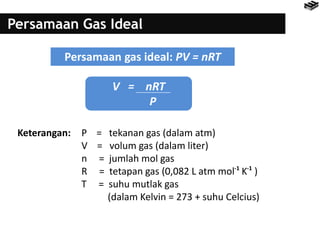
- 20. Persamaan Gas Ideal V = nRT P Persamaan gas ideal: PV = nRT Keterangan: P = tekanan gas (dalam atm) V = volum gas (dalam liter) n = jumlah mol gas R = tetapan gas (0,082 L atm mol K ) T = suhu mutlak gas (dalam Kelvin = 273 + suhu Celcius) -1 -1
- 21. Kemolaran Larutan M = Keterangan: M = kemolaran larutan n = jumlah mol zat terlarut V = volum larutan Satuan kemolaran adalah mol L atau mmol mL .-1 -1 Konsentrasi (kemolaran) larutan biasanya ditunjukkan dengan label yang tertempel ada botol. n V
- 22. Menentukan Rumus Empiris Rumus empiris atau rumus perbandingan suatu senyawa menyatakan perbandingan paling sederhana dari atom-atom unsur penyusun senyawa. Data yang diperlukan untuk penentuan rumus empiris adalah: 1) Jenis unsur penyusun senyawa 2) Perbandingan massa antarunsur dalam senyawa
- 23. Contoh -1 Suatu senyawa mengandung unsur karbon, hidrogen, dan oksigen. Dari analisis dikerahui bahwa dalam 3gram senyawa itu terdapat 1,2 gram karbon, 0,2 gram hidrogen, dan sisanya adalah oksigen. (Ar H= 1; C = 12; dan O = 16) Jumlah mol C = 1,2 g = 0,1 mol 12 g mol Jumlah mol H = 0,2 g = 0,2 mol 1 g mol Massa O = 3 ŌĆō (1,2 + 0,2) gram = 1,6 gram. Jumlah mol O = 1,6 g = 0,1 mol 16 g mol Perbandingan mol C : H : O = 0,1 : 0,2 : 0,1 = 1 : 2 : 1. Rumus empiris senyawa tersebut adalah CH2O. -1 -1
- 24. Menentukan Rumus Molekul Secara umum, jika rumus empiris senyawa adalah RE, maka rumus molekulnya dapat dinyatakan sebagai (RE)n; harga n bergantung pada massa molekul relatif (Mr) dari senyawa yang bersangkutan. Contoh: Senyawa X mempunyai rumus empiris CH2O dan massa molekul relatif (Mr) = 60. Diketahui rumus empiris senyawa adalah CH2O. Misalkan rumus molekul senyawa itu (CH2O)Žć. Mr (CH2O)Žć = 60 (12 + 2 + 16)Žć = 60 30Žć = 60 Žć = 2 Jadi, rumus molekul senyawa itu adalah (CH2O)2 atau C2H4O2.
- 25. Kadar Unsur dalam Senyawa Žć adalah jumlah atom unsur dalam 1 molekul senyawa = indeks dari unsur yang bersangkutan dalam rumus kimia senyawa. Contoh: Kadar C dan N dalam urea, CO(NH2)2? (Ar H = 1; C = 12; dan O = 16) Kadar unsur X = Žć x Ar unsur X x 100% Mr senyawa Mr urea = 12 + 16 + 28 + 4 = 60 Kadar C = (1 x 12) x 100% = 20% 60 Kadar N = (2 x 14) x 100% = 46,67% 60
- 26. Pereaksi Pembatas Pereaksi pembatas adalah pereaksi yang habis lebih dahulu. Contoh: 4Al(s) = 3O2(g) 2Al2O3(s) Persamaan reaksi menunjukkan bahwa perbandingan mol alumunium dengan oksigen adalah 4 : 3. ’é¦ Jika jumlah mol yang direaksikan sesuai dengan perbandingan itu, maka kedua pereaksi itu akan habis. ’é¦ Jika jumlah mol yang direaksikan tidak 4 : 3, maka salah satu pereaksi akan habis lebih dulu.
- 27. Pereaksi Pembatas Pereaksi pembatas adalah pereaksi yang habis lebih dahulu. Contoh: 4Al(s) = 3O2(g) 2Al2O3(s) Persamaan reaksi menunjukkan bahwa perbandingan mol alumunium dengan oksigen adalah 4 : 3. ’é¦ Jika jumlah mol yang direaksikan sesuai dengan perbandingan itu, maka kedua pereaksi itu akan habis. ’é¦ Jika jumlah mol yang direaksikan tidak 4 : 3, maka salah satu pereaksi akan habis lebih dulu.
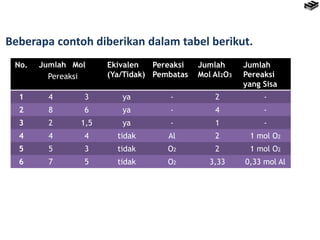
- 28. Beberapa contoh diberikan dalam tabel berikut. No. Jumlah Mol Ekivalen (Ya/Tidak) Pereaksi Pembatas Jumlah Mol Al2O3 Jumlah Pereaksi yang Sisa 1 4 3 ya - 2 - 2 8 6 ya - 4 - 3 2 1,5 ya - 1 - 4 4 4 tidak Al 2 1 mol O2 5 5 3 tidak O2 2 1 mol O2 6 7 5 tidak O2 3,33 0,33 mol Al Pereaksi
- 29. Menentukan Rumus Kimia Hidrat Hidrat adalah zat padat yang mengikat beberapa molekul air sebagai bagian dari struktur kristalnya. Contoh: 1. Terusi, CuSO4.5H2O : tembaga(II) sulfat pentahidrat 2. Gipsum, CaSO4.2H2O : kalsium sulfat dihidrat 3. Garam inggris, MgSO4.7H2O : magnesium sulfat heptahidrat 4. Soda hablur, Na2CO3.10H2O : natrium karbonat dekahidrat
- 30. Menentukan Rumus Kimia Hidrat Jika suatu hidrat dipanaskan, sebagian atau seluruh air kristalnya dapat lepas (menguap). Ketika dipanaskan, kristal biru tembaga(II) sulfat pentahidrat berubah menjadi tembaga(II) sulfat anhidrat Gambar 1 yang berwarna putih.