Bab6larutanelektrolitkelasx 141109050211-conversion-gate02
Download as ppt, pdf1 like308 views
Dokumen ini membahas tentang larutan elektrolit dan nonelektrolit, serta reaksi redoks dalam kimia. Larutan elektrolit mengandung ion yang dapat menghantarkan listrik, sedangkan nonelektrolit tidak. Selain itu, dokumen menjelaskan konsep oksidasi dan reduksi, bersama dengan penentuan bilangan oksidasi dan tata nama senyawa berdasarkan IUPAC.
1 of 16
Download to read offline










Ad
Recommended
Bab 6 larutan dan konsep redoks
Bab 6 larutan dan konsep redokswafiqasfari
Ěý
Dokumen ini membahas larutan elektrolit dan nonelektrolit, serta reaksi redoks yang melibatkan oksidasi dan reduksi. Larutan elektrolit dapat menghantarkan listrik karena mengandung ion yang bergerak bebas, sementara elektrolit dibedakan menjadi kuat dan lemah berdasarkan derajat ionisasinya. Selain itu, dokumen ini juga menjelaskan cara menentukan bilangan oksidasi dan tata nama senyawa berdasarkan konvensi IUPAC.Bab6 larutan elektrolit dan konsep redoks
Bab6 larutan elektrolit dan konsep redoks Taofik Dinata
Ěý
Dokumen tersebut membahas tentang larutan elektrolit dan konsep redoks. Secara ringkas, dokumen menjelaskan bahwa larutan elektrolit mampu menghantarkan arus listrik karena mengandung ion yang dapat bergerak bebas, sedangkan larutan non-elektrolit tidak. Dokumen juga menjelaskan konsep redoks sebagai reaksi pelepasan dan penerimaan elektron, di mana zat yang melepas elektron mengalami oksidasi dan larutan elektrolit dan konsep redoks
larutan elektrolit dan konsep redoksmfebri26
Ěý
Dokumen tersebut membahas tentang larutan elektrolit dan nonelektrolit, teori ion Svante Arrhenius, jenis-jenis elektrolit, konsep redoks, bilangan oksidasi, dan tata nama senyawa IUPAC.Bab 6 larutan elektrolit dan konsep redoks
Bab 6 larutan elektrolit dan konsep redoksbaliviri xi-tkj
Ěý
Dokumen ini menjelaskan tentang larutan elektrolit dan nonelektrolit serta reaksi redoks, termasuk perbedaan antara elektrolit kuat dan lemah serta konsep oksidasi-reduksi. Larutan elektrolit dapat menghantar listrik karena mengandung ion yang bergerak bebas, sedangkan reaksi redoks melibatkan pengikatan atau pelepasan oksigen, elektron, serta perubahan bilangan oksidasi. Selain itu, dokumen ini juga membahas tata nama senyawa berdasarkan aturan IUPAC.Perbandingan larutan yang mengandung elektrolite
Perbandingan larutan yang mengandung elektrolitebaliviri xitkj
Ěý
Dokumen ini membahas perbedaan antara larutan elektrolit dan nonelektrolit, serta konsep oksidasi-reduksi dan bilangan oksidasi. Larutan elektrolit dapat menghantarkan listrik karena mengandung ion bebas, sedangkan nonelektrolit tidak. Selain itu, disebutkan juga pentingnya tata nama senyawa berdasarkan tingkat oksidasi menurut standar IUPAC.larutan Elektrolit and redoks.pps/KIMIA SMA
larutan Elektrolit and redoks.pps/KIMIA SMAIra Sigit
Ěý
Dokumen ini membahas larutan elektrolit yang dapat menghantarkan listrik, serta perbedaan antara elektrolit kuat, lemah, dan non-elektrolit. Selain itu, dijelaskan tentang konsep redoks yang melibatkan reaksi reduksi dan oksidasi, serta penghitungan bilangan oksidasi untuk berbagai unsur. Contoh reaksinya juga diberikan untuk memperjelas konsep-konsep tersebut.Larutan Elektrolit dan Reaksi Redoks
Larutan Elektrolit dan Reaksi Redokskintan ayu siva
Ěý
Dokumen ini menjelaskan pengertian dan aplikasi elektrolit dalam kehidupan sehari-hari, termasuk fungsi ion dalam menghantarkan listrik. Terdapat dua kategori elektrolit yaitu elektrolit kuat dan lemah, serta peran penting redoks dalam reaksi kimia. Selain itu, dijelaskan juga contoh aplikasi seperti penggunaan elektrolit dalam aki kendaraan dan pengolahan air.Reaksi redoks
Reaksi redoksumar_MUH
Ěý
Dokumen ini menjelaskan tentang reaksi reduksi oksidasi (redoks), di mana oksidasi melibatkan pengikatan oksigen dan pelepasan elektron, sedangkan reduksi melibatkan pelepasan oksigen dan penyerapan elektron. Contoh reaksi redoks yang dijelaskan termasuk oksidasi besi, reduksi bijih logam, dan perubahan bilangan oksidasi dalam berbagai senyawa. Selain itu, terdapat aturan untuk menentukan bilangan oksidasi unsur-unsur dalam senyawa kimia.Redoks & elektrokimia
Redoks & elektrokimiaRaafqi Ranasasmita
Ěý
Tiga kalimat ringkasan dokumen tersebut adalah:
Dokumen tersebut membahas tentang reaksi redoks dan elektrokimia, mulai dari pengertian reaksi oksidasi dan reduksi, oksidator dan reduktor, bilangan oksidasi, penyetaraan persamaan redoks, dan jenis-jenis sel elektrokimia seperti sel galvanik dan sel elektrolisis.Reaksi oksidasi-reduksi
Reaksi oksidasi-reduksiEKO SUPRIYADI
Ěý
Dokumen ini membahas reaksi oksidasi-reduksi (redoks), menjelaskan proses oksidasi sebagai pelepasan elektron dan peningkatan bilangan oksidasi, serta reduksi sebagai penangkapan elektron dan penurunan bilangan oksidasi. Terdapat penjelasan tentang oksidator dan reduktor, serta tabel yang menunjukkan contoh zat, kondisi reaksi, dan langkah-langkah dalam penyetaraan persamaan redoks di lingkungan asam dan basa. Juga disertakan contoh perhitungan bilangan oksidasi dan penyetaraan reaksi dengan penyempurnaan koefisien reaksi.Reaks Oksidasi Dan Reduksi
Reaks Oksidasi Dan ReduksiPuswita Septia Usman
Ěý
Dokumen ini membahas reaksi redoks dan elektrokimia, termasuk konsep oksidasi dan reduksi serta cara menyetarakan persamaan reaksi. Oksidasi dan reduksi melibatkan perpindahan elektron yang dapat ditandai dengan bilangan oksidasi. Selain itu, dokumen juga membahas sel volta sebagai alat untuk memanfaatkan energi dari reaksi redoks dan menjelaskan berbagai konsep seperti emf dan kespontanan reaksi.Reaksi reduksi oksidasi (redoks) gustria
Reaksi reduksi oksidasi (redoks) gustriaGustria Ernis
Ěý
Dokumen ini menjelaskan sejarah dan konsep reaksi reduksi oksidasi (redoks), termasuk definisi, klasifikasi, dan aplikasi dalam kehidupan sehari-hari. Reaksi redoks melibatkan transfer elektron dan perubahan bilangan oksidasi, dengan pengoksidasi dan pereduksi sebagai komponen penting dalam proses ini. Selain itu, terdapat contoh praktis seperti penggaratan logam dan reaksi dalam fotografi.Kimia
KimiaMonica Natasha
Ěý
Dokumen tersebut membahas tentang konsentrasi larutan dan berbagai cara mengukur konsentrasi larutan seperti molaritas, molalitas, normalitas, fraksi mol, persen berat dan bagian per juta. Juga dibahas tentang perbedaan larutan elektrolit dan non elektrolit serta faktor yang mempengaruhi kekuatan larutan elektrolit.REAKSI KIMIA
REAKSI KIMIAAndi Himyatul Hidayah
Ěý
Dokumen tersebut membahas tentang reaksi kimia dalam air dan penggolongan zat terlarut dalam larutan berair menjadi elektrolit kuat, elektrolit lemah, dan nonelektrolit."Dewi's Redoks ppt
Dewi's Redoks pptSMA Negeri 2 Tuban
Ěý
Dokumen ini membahas reaksi oksidasi dan reduksi, serta konsep-konsep terkait bilangan oksidasi dan penerapannya dalam reaksi kimia. Terdapat penjelasan mengenai proses oksidasi dan reduksi dengan contoh reaksi, serta aturan penentuan bilangan oksidasi dalam senyawa. Selain itu, juga terdapat latihan soal untuk mempertajam pemahaman mengenai materi tersebut.Re
ReWikiwikpunana Uyuun
Ěý
Dokumen tersebut membahas tentang reaksi redoks, termasuk definisi oksidasi dan reduksi, aturan bilangan oksidasi, dan cara penyetaraan persamaan reaksi redoks melalui metode langsung maupun setengah reaksi.Reaksi dalam larutan berair 1
Reaksi dalam larutan berair 1mustajibsakti
Ěý
Dokumen tersebut membahas tentang konsep-konsep dasar kimia larutan seperti komponen larutan, stoikiometri, massa atom dan rumus, konsep mol, persamaan reaksi, dan konsentrasi larutan."Senyawa Redoks
Senyawa Redoksprilla marta
Ěý
Dokumen tersebut memberikan ringkasan konsep reduksi dan oksidasi berdasarkan:
1) Pengikatan dan pelepasan oksigen
2) Pengikatan dan pelepasan elektron
3) Perubahan bilangan oksidasi
Dokumen tersebut juga menjelaskan aturan penentuan bilangan oksidasi dan jenis-jenis reaksi redoks seperti reaksi disproporsionasi dan komproporsionasi.Redoks
RedoksNatalie default
Ěý
Reaksi redoks dan proses oksidasi memainkan peran penting dalam pengolahan air limbah menggunakan sistem lumpur aktif. Sistem ini menggunakan bak pengolahan yang berisi partikel-partikel lumpur yang bercampur dengan air limbah. Bakteri dalam lumpur membentuk flok yang akan mengendapkan zat-zat teroksidasi untuk memisahkannya dari air. Proses oksidasi menghilangkan zat pencemar seperti karbon organik dan nitrogen. Sistem lumpur aktRedokselektrokimia xii
Redokselektrokimia xii andhy28
Ěý
Elektrokimia adalah ilmu yang mempelajari hubungan antara perubahan kimia dengan kerja listrik melalui sel elektrokimia. Sel elektrokimia dapat berupa sel galvanik yang menghasilkan energi listrik akibat reaksi redoks spontan, atau sel elektrolisis yang memisahkan zat melalui proses reduksi dan oksidasi dengan bantuan energi listrik dari luar. Unsur-unsur dalam sel elektrokimia terhubung melalui sirkuit luar yangPemanfaatan it & ict larutan elektrolit dan nonelektrolit
Pemanfaatan it & ict larutan elektrolit dan nonelektrolitamaliafitrah81
Ěý
Dokumen tersebut membahas tentang karakteristik larutan nonelektrolit dan elektrolit, termasuk pengertian, contoh, dan kemampuan elektrolit untuk menghantarkan arus listrik karena terjadinya reaksi ionisasi. Dokumen ini juga menjelaskan model pembelajaran, pendekatan, dan media pengajaran yang digunakan untuk materi pelajaran tersebut.PENYETARAAN REAKSI REDOKS DENGAN CARA SETENGAH REAKSI
PENYETARAAN REAKSI REDOKS DENGAN CARA SETENGAH REAKSINesha Mutiara
Ěý
Dokumen ini membahas metode penyetaraan reaksi redoks menggunakan setengah reaksi, di mana jumlah elektron pada kedua setengah reaksi harus disamakan. Langkah-langkah penyetaraan dijelaskan untuk suasana asam dan basa, termasuk cara menangani ion H+ dan OH-. Contoh soal juga disediakan untuk mengilustrasikan proses penyetaraan reaksi redoks.reaksi redoks dan elektrokimia
reaksi redoks dan elektrokimiamfebri26
Ěý
Bab 2 membahas reaksi redoks dan elektrokimia, termasuk penyetaraan reaksi redoks, sel volta, elektrolisis, dan korosi. Metode penyetaraan reaksi redoks meliputi penentuan koefisien dan muatan untuk memperoleh kesetimbangan reaksi. Sel volta menghasilkan aliran listrik melalui oksidasi di anode dan reduksi di katode. Elektrolisis melibatkan reaksi redoks di kedua elektrode, sementara korosi logam merupSoal penyetaraan reaksi redoks, sel elektrokimia,
Soal penyetaraan reaksi redoks, sel elektrokimia,Retno Widowati
Ěý
Dokumen ini membahas penyetaraan reaksi redoks dan sel elektrokimia dengan memberikan soal-soal terkait. Contoh reaksi meliputi reaksi antara tembaga dan asam sulfat serta reaksi sel volta yang menghasilkan arus listrik. Selain itu, terdapat informasi mengenai elektroda dan potensial sel dalam konteks reaksi kimia.Bab 4 larutan elektrolit, non-elektrolit, dan reaksi redoks
Bab 4 larutan elektrolit, non-elektrolit, dan reaksi redoksNasywaSalsabilaIX1
Ěý
Dokumen tersebut membahas tentang larutan elektrolit, non-elektrolit, dan reaksi redoks. Larutan dapat dibedakan menjadi elektrolit yang dapat menghantarkan listrik karena mengandung ion, dan non-elektrolit yang tidak menghantarkan listrik. Reaksi redoks melibatkan reaksi oksidasi dan reduksi dimana terjadi perpindahan elektron.Bab6 laru
Bab6 laruHidayati Rusnedy
Ěý
BAB 6 membahas larutan elektrolit dan konsep redoks. Larutan elektrolit mampu menghantar listrik karena mengandung ion yang bergerak bebas, seperti NaCl dan HCl. Teori ini dijelaskan oleh Arrhenius. Elektrolit dapat kuat atau lemah tergantung derajat ionisasinya. Reaksi redoks melibatkan proses oksidasi dan reduksi, yakni pelepasan dan penerimaan elektron. Bilangan oksidasi menunjukkan muMelda
MeldaAli Husni
Ěý
Dokumen ini menjelaskan konsep oksidasi dan reduksi (redoks) dalam kimia, termasuk reaksi yang melibatkan transfer oksigen, hidrogen, dan elektron. Ditekankan bahwa reaksi redoks melibatkan perubahan bilangan oksidasi dan mencakup berbagai contoh serta metode penyetaraan reaksi. Selain itu, dibahas pula tentang potensial elektroda dan hubungan antara energi bebas Gibbs dan konstanta kesetimbangan dalam konteks reaksi redoks.Reaksi reduksi oksidasi (redoks) gustria
Reaksi reduksi oksidasi (redoks) gustriaGustria Ernis
Ěý
Tiga kalimat ringkasan dokumen tersebut adalah:
Dokumen tersebut membahas sejarah lahirnya konsep reaksi redoks sejak abad ke-16 hingga perkembangannya, termasuk penjelasan tentang oksidasi, reduksi, oksidator, dan reduktor. Dokumen tersebut juga memberikan contoh perhitungan bilangan oksidasi pada beberapa senyawa kimia.Reaksi reduksi oksidasi (redoks) gustria
Reaksi reduksi oksidasi (redoks) gustriaGustria Ernis
Ěý
Dokumen ini membahas reaksi reduksi oksidasi (redoks) mulai dari sejarah konsep hingga definisi dan klasifikasinya. Proses redoks melibatkan serah terima elektron dan perubahan bilangan oksidasi, dengan oksidasi dan reduksi yang didefinisikan secara berbeda. Selain itu, terdapat aplikasi reaksi redoks dalam kehidupan sehari-hari, seperti pengaratan logam dan proses fotografi.Reduksi oksidasi
Reduksi oksidasiMadrasah Aliyah Citra Cendekia
Ěý
Dokumen ini menjelaskan konsep reduksi dan oksidasi (reaksi redoks), termasuk perbedaan antara reaksi reduksi yang menangkap elektron dan oksidasi yang melepas elektron, serta contoh-contoh reaksinya. Selain itu, dijelaskan juga aturan dalam menentukan bilangan oksidasi suatu unsur dan cara mendeteksi apakah suatu reaksi tergolong redoks atau bukan. Penulis juga memberikan petunjuk untuk menentukan reduktor dan oksidator dalam reaksi redoks serta jenis-jenis reaksi terkait.More Related Content
What's hot (17)
Redoks & elektrokimia
Redoks & elektrokimiaRaafqi Ranasasmita
Ěý
Tiga kalimat ringkasan dokumen tersebut adalah:
Dokumen tersebut membahas tentang reaksi redoks dan elektrokimia, mulai dari pengertian reaksi oksidasi dan reduksi, oksidator dan reduktor, bilangan oksidasi, penyetaraan persamaan redoks, dan jenis-jenis sel elektrokimia seperti sel galvanik dan sel elektrolisis.Reaksi oksidasi-reduksi
Reaksi oksidasi-reduksiEKO SUPRIYADI
Ěý
Dokumen ini membahas reaksi oksidasi-reduksi (redoks), menjelaskan proses oksidasi sebagai pelepasan elektron dan peningkatan bilangan oksidasi, serta reduksi sebagai penangkapan elektron dan penurunan bilangan oksidasi. Terdapat penjelasan tentang oksidator dan reduktor, serta tabel yang menunjukkan contoh zat, kondisi reaksi, dan langkah-langkah dalam penyetaraan persamaan redoks di lingkungan asam dan basa. Juga disertakan contoh perhitungan bilangan oksidasi dan penyetaraan reaksi dengan penyempurnaan koefisien reaksi.Reaks Oksidasi Dan Reduksi
Reaks Oksidasi Dan ReduksiPuswita Septia Usman
Ěý
Dokumen ini membahas reaksi redoks dan elektrokimia, termasuk konsep oksidasi dan reduksi serta cara menyetarakan persamaan reaksi. Oksidasi dan reduksi melibatkan perpindahan elektron yang dapat ditandai dengan bilangan oksidasi. Selain itu, dokumen juga membahas sel volta sebagai alat untuk memanfaatkan energi dari reaksi redoks dan menjelaskan berbagai konsep seperti emf dan kespontanan reaksi.Reaksi reduksi oksidasi (redoks) gustria
Reaksi reduksi oksidasi (redoks) gustriaGustria Ernis
Ěý
Dokumen ini menjelaskan sejarah dan konsep reaksi reduksi oksidasi (redoks), termasuk definisi, klasifikasi, dan aplikasi dalam kehidupan sehari-hari. Reaksi redoks melibatkan transfer elektron dan perubahan bilangan oksidasi, dengan pengoksidasi dan pereduksi sebagai komponen penting dalam proses ini. Selain itu, terdapat contoh praktis seperti penggaratan logam dan reaksi dalam fotografi.Kimia
KimiaMonica Natasha
Ěý
Dokumen tersebut membahas tentang konsentrasi larutan dan berbagai cara mengukur konsentrasi larutan seperti molaritas, molalitas, normalitas, fraksi mol, persen berat dan bagian per juta. Juga dibahas tentang perbedaan larutan elektrolit dan non elektrolit serta faktor yang mempengaruhi kekuatan larutan elektrolit.REAKSI KIMIA
REAKSI KIMIAAndi Himyatul Hidayah
Ěý
Dokumen tersebut membahas tentang reaksi kimia dalam air dan penggolongan zat terlarut dalam larutan berair menjadi elektrolit kuat, elektrolit lemah, dan nonelektrolit."Dewi's Redoks ppt
Dewi's Redoks pptSMA Negeri 2 Tuban
Ěý
Dokumen ini membahas reaksi oksidasi dan reduksi, serta konsep-konsep terkait bilangan oksidasi dan penerapannya dalam reaksi kimia. Terdapat penjelasan mengenai proses oksidasi dan reduksi dengan contoh reaksi, serta aturan penentuan bilangan oksidasi dalam senyawa. Selain itu, juga terdapat latihan soal untuk mempertajam pemahaman mengenai materi tersebut.Re
ReWikiwikpunana Uyuun
Ěý
Dokumen tersebut membahas tentang reaksi redoks, termasuk definisi oksidasi dan reduksi, aturan bilangan oksidasi, dan cara penyetaraan persamaan reaksi redoks melalui metode langsung maupun setengah reaksi.Reaksi dalam larutan berair 1
Reaksi dalam larutan berair 1mustajibsakti
Ěý
Dokumen tersebut membahas tentang konsep-konsep dasar kimia larutan seperti komponen larutan, stoikiometri, massa atom dan rumus, konsep mol, persamaan reaksi, dan konsentrasi larutan."Senyawa Redoks
Senyawa Redoksprilla marta
Ěý
Dokumen tersebut memberikan ringkasan konsep reduksi dan oksidasi berdasarkan:
1) Pengikatan dan pelepasan oksigen
2) Pengikatan dan pelepasan elektron
3) Perubahan bilangan oksidasi
Dokumen tersebut juga menjelaskan aturan penentuan bilangan oksidasi dan jenis-jenis reaksi redoks seperti reaksi disproporsionasi dan komproporsionasi.Redoks
RedoksNatalie default
Ěý
Reaksi redoks dan proses oksidasi memainkan peran penting dalam pengolahan air limbah menggunakan sistem lumpur aktif. Sistem ini menggunakan bak pengolahan yang berisi partikel-partikel lumpur yang bercampur dengan air limbah. Bakteri dalam lumpur membentuk flok yang akan mengendapkan zat-zat teroksidasi untuk memisahkannya dari air. Proses oksidasi menghilangkan zat pencemar seperti karbon organik dan nitrogen. Sistem lumpur aktRedokselektrokimia xii
Redokselektrokimia xii andhy28
Ěý
Elektrokimia adalah ilmu yang mempelajari hubungan antara perubahan kimia dengan kerja listrik melalui sel elektrokimia. Sel elektrokimia dapat berupa sel galvanik yang menghasilkan energi listrik akibat reaksi redoks spontan, atau sel elektrolisis yang memisahkan zat melalui proses reduksi dan oksidasi dengan bantuan energi listrik dari luar. Unsur-unsur dalam sel elektrokimia terhubung melalui sirkuit luar yangPemanfaatan it & ict larutan elektrolit dan nonelektrolit
Pemanfaatan it & ict larutan elektrolit dan nonelektrolitamaliafitrah81
Ěý
Dokumen tersebut membahas tentang karakteristik larutan nonelektrolit dan elektrolit, termasuk pengertian, contoh, dan kemampuan elektrolit untuk menghantarkan arus listrik karena terjadinya reaksi ionisasi. Dokumen ini juga menjelaskan model pembelajaran, pendekatan, dan media pengajaran yang digunakan untuk materi pelajaran tersebut.PENYETARAAN REAKSI REDOKS DENGAN CARA SETENGAH REAKSI
PENYETARAAN REAKSI REDOKS DENGAN CARA SETENGAH REAKSINesha Mutiara
Ěý
Dokumen ini membahas metode penyetaraan reaksi redoks menggunakan setengah reaksi, di mana jumlah elektron pada kedua setengah reaksi harus disamakan. Langkah-langkah penyetaraan dijelaskan untuk suasana asam dan basa, termasuk cara menangani ion H+ dan OH-. Contoh soal juga disediakan untuk mengilustrasikan proses penyetaraan reaksi redoks.reaksi redoks dan elektrokimia
reaksi redoks dan elektrokimiamfebri26
Ěý
Bab 2 membahas reaksi redoks dan elektrokimia, termasuk penyetaraan reaksi redoks, sel volta, elektrolisis, dan korosi. Metode penyetaraan reaksi redoks meliputi penentuan koefisien dan muatan untuk memperoleh kesetimbangan reaksi. Sel volta menghasilkan aliran listrik melalui oksidasi di anode dan reduksi di katode. Elektrolisis melibatkan reaksi redoks di kedua elektrode, sementara korosi logam merupSoal penyetaraan reaksi redoks, sel elektrokimia,
Soal penyetaraan reaksi redoks, sel elektrokimia,Retno Widowati
Ěý
Dokumen ini membahas penyetaraan reaksi redoks dan sel elektrokimia dengan memberikan soal-soal terkait. Contoh reaksi meliputi reaksi antara tembaga dan asam sulfat serta reaksi sel volta yang menghasilkan arus listrik. Selain itu, terdapat informasi mengenai elektroda dan potensial sel dalam konteks reaksi kimia.Bab 4 larutan elektrolit, non-elektrolit, dan reaksi redoks
Bab 4 larutan elektrolit, non-elektrolit, dan reaksi redoksNasywaSalsabilaIX1
Ěý
Dokumen tersebut membahas tentang larutan elektrolit, non-elektrolit, dan reaksi redoks. Larutan dapat dibedakan menjadi elektrolit yang dapat menghantarkan listrik karena mengandung ion, dan non-elektrolit yang tidak menghantarkan listrik. Reaksi redoks melibatkan reaksi oksidasi dan reduksi dimana terjadi perpindahan elektron.Similar to Bab6larutanelektrolitkelasx 141109050211-conversion-gate02 (20)
Bab6 laru
Bab6 laruHidayati Rusnedy
Ěý
BAB 6 membahas larutan elektrolit dan konsep redoks. Larutan elektrolit mampu menghantar listrik karena mengandung ion yang bergerak bebas, seperti NaCl dan HCl. Teori ini dijelaskan oleh Arrhenius. Elektrolit dapat kuat atau lemah tergantung derajat ionisasinya. Reaksi redoks melibatkan proses oksidasi dan reduksi, yakni pelepasan dan penerimaan elektron. Bilangan oksidasi menunjukkan muMelda
MeldaAli Husni
Ěý
Dokumen ini menjelaskan konsep oksidasi dan reduksi (redoks) dalam kimia, termasuk reaksi yang melibatkan transfer oksigen, hidrogen, dan elektron. Ditekankan bahwa reaksi redoks melibatkan perubahan bilangan oksidasi dan mencakup berbagai contoh serta metode penyetaraan reaksi. Selain itu, dibahas pula tentang potensial elektroda dan hubungan antara energi bebas Gibbs dan konstanta kesetimbangan dalam konteks reaksi redoks.Reaksi reduksi oksidasi (redoks) gustria
Reaksi reduksi oksidasi (redoks) gustriaGustria Ernis
Ěý
Tiga kalimat ringkasan dokumen tersebut adalah:
Dokumen tersebut membahas sejarah lahirnya konsep reaksi redoks sejak abad ke-16 hingga perkembangannya, termasuk penjelasan tentang oksidasi, reduksi, oksidator, dan reduktor. Dokumen tersebut juga memberikan contoh perhitungan bilangan oksidasi pada beberapa senyawa kimia.Reaksi reduksi oksidasi (redoks) gustria
Reaksi reduksi oksidasi (redoks) gustriaGustria Ernis
Ěý
Dokumen ini membahas reaksi reduksi oksidasi (redoks) mulai dari sejarah konsep hingga definisi dan klasifikasinya. Proses redoks melibatkan serah terima elektron dan perubahan bilangan oksidasi, dengan oksidasi dan reduksi yang didefinisikan secara berbeda. Selain itu, terdapat aplikasi reaksi redoks dalam kehidupan sehari-hari, seperti pengaratan logam dan proses fotografi.Reduksi oksidasi
Reduksi oksidasiMadrasah Aliyah Citra Cendekia
Ěý
Dokumen ini menjelaskan konsep reduksi dan oksidasi (reaksi redoks), termasuk perbedaan antara reaksi reduksi yang menangkap elektron dan oksidasi yang melepas elektron, serta contoh-contoh reaksinya. Selain itu, dijelaskan juga aturan dalam menentukan bilangan oksidasi suatu unsur dan cara mendeteksi apakah suatu reaksi tergolong redoks atau bukan. Penulis juga memberikan petunjuk untuk menentukan reduktor dan oksidator dalam reaksi redoks serta jenis-jenis reaksi terkait.Materi redoks
Materi redoksTri Hartatjj
Ěý
Dokumen ini membahas tentang penyetaraan reaksi redoks, termasuk pengertian, bilangan oksidasi, dan metode penyetaraan baik dalam suasana asam maupun basa. Terdapat penjelasan tentang reaksi oksidasi dan reduksi, serta contoh latihan soal untuk memahami cara penentuan bilangan oksidasi dan penyetaraan reaksi. Metode yang dibahas meliputi metode setengah reaksi dan metode bilangan oksidasi.Reaksi redoks
Reaksi redoksRifka Wangiana Yulia Putri
Ěý
Dokumen tersebut membahas tiga konsep perkembangan pengertian reaksi redoks, yaitu berdasarkan pengikatan dan pelepasan oksigen, pengikatan dan pelepasan elektron, serta perubahan bilangan oksidasi. Reaksi redoks dijelaskan sebagai reaksi oksidasi dan reduksi, dengan kriteria perubahan bilangan oksidasi unsur kimia yang terlibat.larutan dan stoikiometri...................
larutan dan stoikiometri...................LetdaSusIPutuBagusMa
Ěý
Dokumen menjelaskan tentang reaksi kimia dan stoikiometri larutan, membedakan antara larutan elektrolit dan non-elektrolit serta contoh senyawanya. Selain itu, dibahas juga reaksi reduksi-oksidasi, reaksi asam-basa, reaksi pengendapan, dan perhitungan stokiometri yang melibatkan konsentrasi larutan. Ini memberikan pemahaman mendalam terkait karakteristik zat dalam larutan serta perhitungannya dalam berbagai reaksi kimia.Reaksi reduksi oksidasi
Reaksi reduksi oksidasiFriska Purba Sidadolog
Ěý
Dokumen ini membahas reaksi redoks (reduksi-oksidasi) dan penentuan bilangan oksidasi pada senyawa kimia. Reaksi redoks melibatkan transfer elektron antara reduktor dan oksidator, di mana reduktor mengalami oksidasi dan oksidator mengalami reduksi. Bilangan oksidasi ditentukan berdasarkan distribusi elektron ikatan dan menunjukkan jumlah muatan suatu atom dalam senyawa.Reaksi reduksi oksidasi (Redoks)
Reaksi reduksi oksidasi (Redoks)Friska Purba Sidadolog
Ěý
Dokumen ini membahas reaksi reduksi oksidasi (redoks), yang meliputi pengertian oksidasi dan reduksi terkait elektron dan bilangan oksidasi. Oksidasi diartikan sebagai pelepasan elektron sementara reduksi adalah penyerapan elektron, serta memberikan contoh reaksi kimia yang relevan. Selain itu, terdapat penjelasan mengenai penentuan bilangan oksidasi unsur dan contoh-contoh soal terkait.Reaksi reduksi dan oksidasi
Reaksi reduksi dan oksidasitrisucihandayani
Ěý
Dokumen ini menjelaskan konsep penyetaraan reaksi redoks, termasuk metode setengah reaksi dan bilangan oksidasi, serta penerapan dalam berbagai reaksi kimia. Penjelasan mencakup bagaimana mengidentifikasi reaksi redoks, menentukan bilangan oksidasi, dan contoh persamaan reaksi yang dapat disetarakan. Selain itu, juga dibahas beberapa reaksi redoks yang terjadi di kehidupan sehari-hari dan teknik penyetaraan dalam suasana asam dan basa.bab 5 Larutan elektrolit dan konsep redoks.pptx
bab 5 Larutan elektrolit dan konsep redoks.pptxSriIrmayani5
Ěý
Dokumen ini membahas konsep larutan elektrolit dan nonelektrolit, termasuk pengertian, teori ion, dan karakteristik penghantaran listrik. Selain itu, dijelaskan tentang reaksi redoks, termasuk definisi, perkembangan konsep, dan bilangan oksidasi. Selain itu, terdapat informasi mengenai pengolahan air kotor dengan penjelasan tentang tahap-tahap dalam prosesnya.Reaksi reduksi oksidasi (melani punya)
Reaksi reduksi oksidasi (melani punya)wahyu321
Ěý
Dokumen ini membahas reaksi reduksi oksidasi (redoks) dengan fokus pada pengertian oksidasi dan reduksi serta contoh-contohnya. Oksidasi didefinisikan sebagai pelepasan elektron, sementara reduksi adalah penyerapan elektron, dan keduanya terjadi bersamaan dalam setiap reaksi redoks. Selain itu, dokumen juga menjelaskan bilangan oksidasi dan cara menentukannya, termasuk aturan dan contoh aplikasi dalam senyawa.Reaksi_redoks_xii_swd.ppt
Reaksi_redoks_xii_swd.pptAzharSchecter
Ěý
Dokumen ini membahas penyetaraan reaksi redoks untuk siswa kelas XII IPA, dengan fokus pada reaksi oksidasi dan reduksi serta metode penyetaraan yang akurat. Penjelasan mencakup konsep dasar bilangan oksidasi dan langkah-langkah untuk menyetarakan reaksi menggunakan metode setengah reaksi dan metode bilangan oksidasi. Terdapat juga contoh latihan soal dan solusi untuk membantu pemahaman lebih lanjut.Reaksi redoks-xii swd
Reaksi redoks-xii swdAnnisa Khoerunnisya
Ěý
Dokumen ini membahas penyetaraan reaksi redoks untuk siswa kelas XII IPA, mencakup standar kompetensi dan metode penyetaraan reaksi seperti metode 1/2 reaksi dan metode bilangan oksidasi. Terdapat penjelasan mendalam tentang pengertian reaksi redoks, bilangan oksidasi, serta contoh latihan soal untuk menerapkan konsep tersebut. Selain itu, dokumen ini berisi pembahasan rinci mengenai cara penyetaraan reaksi dalam suasana asam dan basa.reaksi-redoks-xii_swd tingkat sma dan ma.ppt
reaksi-redoks-xii_swd tingkat sma dan ma.pptakhmadprasetya2
Ěý
Dokumen ini membahas penyetaraan reaksi redoks dalam kimia, dengan fokus pada pengertian, penentuan bilangan oksidasi, dan metode penyetaraan baik dalam suasana asam maupun basa. Terdapat penjelasan tentang reaksi oksidasi dan reduksi serta contoh soal yang melibatkan penyetaraan reaksi. Penulis juga menyajikan dua metode untuk menyetarakan reaksi redoks, yaitu metode setengah reaksi dan metode bilangan oksidasi.Lembar Kerja Siswa - Reaksi Reduksi Oksidasi
Lembar Kerja Siswa - Reaksi Reduksi Oksidasi Medhi Arhiansyah
Ěý
1. Guru menyampaikan materi reaksi redoks dan siswa melakukan praktikum untuk mengamati contoh reaksi redoks.Lks redoks
Lks redokssilviyamandasari
Ěý
Dokumen ini membahas konsep reaksi reduksi-oksidasi (redoks) dalam mata pelajaran kimia untuk siswa kelas X, mencakup definisi, perkembangan konsep, serta contoh penerapannya dalam kehidupan sehari-hari. Materi ini juga mencakup cara mengidentifikasi oksidator dan reduktor, serta penentuan bilangan oksidasi. Selain itu, terdapat juga kegiatan praktikum dan penilaian untuk mengukur pemahaman siswa.Tugas Pe Yen1
Tugas Pe Yen1yenifera
Ěý
Reaksi redoks adalah kombinasi reaksi oksidasi dan reduksi yang melibatkan perpindahan elektron, di mana oksidasi adalah pelepasan elektron dan reduksi adalah pengikatan elektron. Bilangan oksidasi digunakan untuk menentukan keadaan ion dalam senyawa, dan reaksi dikategorikan sebagai redoks jika terdapat zat yang mengalami reduksi dan oksidasi. Contoh reaksi redoks dapat ditemukan dalam pemutihan pakaian, pengaratan logam, dan proses ekstraksi logam.Lks redoks
Lks redoksmohtheaeng
Ěý
Reaksi redoks merupakan reaksi yang melibatkan proses oksidasi dan reduksi. Dokumen ini menjelaskan perkembangan konsep reaksi redoks dari penggabungan dan pelepasan oksigen hingga perubahan bilangan oksidasi, serta contoh reaksi redoks beserta oksidator dan reduktornya.Ad
More from sanoptri (20)
Bab5stoikiometrikelasx 141109050149-conversion-gate01
Bab5stoikiometrikelasx 141109050149-conversion-gate01sanoptri
Ěý
Dokumen ini membahas tentang stoikiometri, termasuk tata nama senyawa, hukum dasar kimia, persamaan reaksi, dan konsep mol. Terdapat penjelasan mengenai senyawa kovalen dan ion, serta cara menyetarakan persamaan reaksi. Selain itu, dijelaskan juga tentang hukum-hukum yang terkait dengan reaksi gas dan penentuan rumus kimia, termasuk rumus empiris dan kadar unsur dalam senyawa.Bab7hidrokarbonkelasx 141109050344-conversion-gate01
Bab7hidrokarbonkelasx 141109050344-conversion-gate01sanoptri
Ěý
Dokumen ini membahas tentang hidrokarbon, karakteristik atom karbon, berbagai jenis hidrokarbon (alkana, alkena, alkuna), serta sifat-sifat dan kegunaan mereka dalam kehidupan sehari-hari. Selain itu, dokumen ini juga menyentuh isu polusi akibat pembakaran bahan bakar fosil dan efek rumah kaca, serta masalah lingkungan seperti hujan asam dan pencemaran udara. Penjelasan teknik penamaan dan reaksi-reaksi kimia hidrokarbon turut disertakan.Bab4ikatankimiakelasx 141109050103-conversion-gate02
Bab4ikatankimiakelasx 141109050103-conversion-gate02sanoptri
Ěý
BAB 4 membahas berbagai jenis ikatan kimia seperti ikatan ion, kovalen, logam, serta pengecualian dan kegagalan aturan oktet. Ikatan terbentuk karena interaksi elektron antaratom untuk mencapai konfigurasi elektron seperti gas mulia. Rumus senyawa dapat diramalkan berdasarkan jumlah elektron yang dilepas dan diserap untuk mencapai aturan oktet.Bab3sistemperiodikkelasx 141109050029-conversion-gate02
Bab3sistemperiodikkelasx 141109050029-conversion-gate02sanoptri
Ěý
Sistem periodik terdiri atas 7 periode dan 18 golongan yang mengelompokkan unsur berdasarkan jumlah kulit elektron dan elektron valensi. Sifat-sifat periodik unsur antara lain jari-jari atom, energi ionisasi, dan keelektronegatifan yang berubah secara berkala di sepanjang periode dan golongan. Beberapa golongan penting adalah gas mulia, halogen, logam alkali, dan logam alkali tanah.Bab7biomolekulkelasxii 141109050225-conversion-gate01
Bab7biomolekulkelasxii 141109050225-conversion-gate01sanoptri
Ěý
Dokumen ini menjelaskan berbagai biomolekul, termasuk protein, karbohidrat, lipid, dan asam nukleat. Protein berfungsi dalam banyak proses biologis dan memiliki struktur yang kompleks, sementara karbohidrat diklasifikasikan berdasarkan ukurannya dan berperan sebagai sumber energi. Lemak dan asam nukleat juga dibahas, dengan penjelasan tentang strukturnya dan fungsi dalam tubuh.Bab6makromulekolkelasxii 141109050217-conversion-gate01
Bab6makromulekolkelasxii 141109050217-conversion-gate01sanoptri
Ěý
Dokumen ini membahas tentang makromolekul (polimer), termasuk proses pembentukan, penggolongan, dan penanganan limbah plastik. Polimer dibedakan menjadi polimer alami dan sintetis, serta homopolimer dan kopolimer berdasarkan jenis monomernya. Selain itu, terdapat informasi mengenai berbagai jenis polimer dan metode daur ulang limbah plastik.Bab5benzenakelasxii 141109050135-conversion-gate02
Bab5benzenakelasxii 141109050135-conversion-gate02sanoptri
Ěý
Dokumen ini membahas struktur, tata nama, sifat, serta kegunaan dan dampak dari benzena dan turunannya. Benzena memiliki beberapa reaksi penting seperti halogenasi, nitrasi, sulfonasi, dan alkilasi. Selain sebagai bahan dasar pembuatan berbagai senyawa, benzena juga memiliki sifat racun dan karsinogen.Bab4senyawaturunankelasxii 141109050130-conversion-gate02
Bab4senyawaturunankelasxii 141109050130-conversion-gate02sanoptri
Ěý
Bab 4 membahas senyawa turunan alkana, termasuk tata namanya, keisomerannya, reaksi kimianya, serta kegunaan dan dampak beberapa senyawa tersebut. Senyawa turunan alkana dijelaskan sebagai senyawa yang berasal dari alkana dengan satu atau lebih atom hidrogen diganti oleh gugus fungsi tertentu.Bab2strukturatomkelasx 141109045943-conversion-gate01
Bab2strukturatomkelasx 141109045943-conversion-gate01sanoptri
Ěý
Dokumen ini membahas struktur atom, termasuk teori atom Dalton, perkembangan teori atom, dan struktur subatom. Teori-teori yang dijelaskan meliputi model atom Thomson, Rutherford, dan Bohr, serta penemuan partikel subatom seperti proton dan neutron. Selain itu, dijelaskan juga tentang konfigurasi elektron dan konsep seperti nomor atom, nomor massa, serta elektron valensi.Bab3kimiaunsurkelasxii 141109050000-conversion-gate02
Bab3kimiaunsurkelasxii 141109050000-conversion-gate02sanoptri
Ěý
Bab 3 membahas tentang kimia unsur, termasuk kelimpahan unsur di alam, sifat unsur logam dan nonlogam beserta penggunaannya, unsur radioaktif, dan penggunaan radioisotop. Unsur-unsur seperti gas mulia, logam, dan nonlogam ditemukan dalam bentuk bebas atau senyawa di alam. Sifat kimia unsur antara lain bergantung pada jari-jari atom, elektron valensi, dan energi ionisasi.Bab2reaskiredokselektrokimakelasxii 141109045919-conversion-gate01
Bab2reaskiredokselektrokimakelasxii 141109045919-conversion-gate01sanoptri
Ěý
Dokumen tersebut membahas tentang reaksi redoks dan elektrokimia, termasuk penyetaraan reaksi redoks, sel volta, elektrolisis, dan korosi. Secara khusus membahas metode penyetaraan reaksi redoks, susunan sel volta, potensial elektrode standar, dan aplikasi elektrolisis dalam industri.Bab1pendahuluankelasx 141109045859-conversion-gate01
Bab1pendahuluankelasx 141109045859-conversion-gate01sanoptri
Ěý
Dokumen ini membahas tentang ilmu kimia, termasuk ruang lingkup, manfaat, dan hubungan dengan ilmu pengetahuan lain, serta sejarah perkembangan ilmu kimia. Kimia mempelajari susunan, sifat, dan perubahan materi serta aplikasinya dalam kehidupan sehari-hari. Selain itu, dokumen ini juga mencakup pengenalan alat laboratorium yang digunakan dalam penelitian kimia.Bab1sifatkoligatifkelasxii 141109045910-conversion-gate01
Bab1sifatkoligatifkelasxii 141109045910-conversion-gate01sanoptri
Ěý
Dokumen ini membahas sifat koligatif larutan, yang meliputi kemolalan, fraksi mol, tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik. Sifat koligatif ini bergantung pada konsentrasi partikel terlarut dan berbeda antara larutan elektrolit dan nonelektrolit. Penggunaan sifat koligatif dalam kehidupan sehari-hari dan industri juga diuraikan, termasuk aplikasi dalam pembuatan cairan antibeku dan desalinasi air laut.Bab9koloidkelasxi 141109050351-conversion-gate02
Bab9koloidkelasxi 141109050351-conversion-gate02sanoptri
Ěý
Dokumen tersebut membahas tentang sistem koloid, termasuk definisi, jenis, sifat, dan cara pembuatan koloid. Koloid adalah sistem heterogen dimana zat terdispersi berukuran 1 nm hingga 100 nm dan tercampur secara homogen di dalam medium dispersi. Terdapat beberapa jenis koloid seperti sol, emulsi, buih, dan gel yang berbeda berdasarkan fase terdispersi dan medium dispersinya. Sifat koloid meliputi efek Tyndall, gerak Brown,Bab8kelarutaandanhasilkelasxi 141109050348-conversion-gate01
Bab8kelarutaandanhasilkelasxi 141109050348-conversion-gate01sanoptri
Ěý
Dokumen ini membahas kelarutan dan hasil kali kelarutan, termasuk metode pengukuran dan aplikasi praktiknya. Dari penjelasan, diungkapkan bahwa kelarutan suatu zat dipengaruhi oleh berbagai faktor seperti pH dan keberadaan ion senama, yang dapat menggeser kesetimbangan dalam larutan. Juga dijelaskan bagaimana kita dapat menentukan kondisi larutan dengan membandingkan nilai reaksi (q) dengan tetapan hasil kali kelarutan (k).Bab6larutanpenyanggakelasxi 141109050213-conversion-gate01
Bab6larutanpenyanggakelasxi 141109050213-conversion-gate01sanoptri
Ěý
Dokumen ini membahas sifat dan komponen larutan penyangga asam dan basa, serta cara kerjanya dalam merespons perubahan pH. Contoh larutan penyangga asam meliputi campuran CH3COOH dan CH3COO-, sedangkan larutan penyangga basa seperti NH3 dan NH4+. Selain itu, sistem penyangga dalam cairan tubuh, seperti dikhidrogenfosfat-monohidrogenfosfat dalam cairan intrasel dan asam karbohidrat-bikarbonat dalam darah, berperan penting dalam menjaga pH tetap konstan.Bab5stoikiometrikelasxi 141109050156-conversion-gate02
Bab5stoikiometrikelasxi 141109050156-conversion-gate02sanoptri
Ěý
Dokumen ini membahas stoikiometri reaksi asam-basa, termasuk pengukuran larutan asam-basa dan cara menghitung pereaksi serta hasil reaksi dalam larutan elektrolit. Dibahas juga reaksi-reaksi yang melibatkan elektrolit kuat dan lemah, metode stoikiometri, serta konsep titrasi asam-basa yang mencakup titik ekivalen dan titik akhir titrasi. Tujuan dari pembelajaran ini adalah untuk memahami sifat larutan asam-basa dan penerapannya dalam perhitungan kimia.Bab4larutanasambasakelasxi 141109050118-conversion-gate01
Bab4larutanasambasakelasxi 141109050118-conversion-gate01sanoptri
Ěý
Bab 5 membahas larutan asam dan basa, termasuk konsep asam dan basa menurut teori Arrhenius, Brønsted-Lowry, dan Lewis. Terdapat penjelasan tentang sifat larutan asam dan basa, pengukuran pH, derajat ionisasi, tetapan ionisasi, dan reaksi antara asam dan basa.Bab3lajureaksi 141112045300-conversion-gate01
Bab3lajureaksi 141112045300-conversion-gate01sanoptri
Ěý
Dokumen ini membahas mengenai laju reaksi kimia, termasuk pengertian dan faktor-faktor yang mempengaruhi laju reaksi seperti kemolaran, suhu, konsentrasi, dan penggunaan katalis. Teori tumbukan juga dijelaskan untuk memahami bagaimana partikel pereaksi bertumbukan dan menghasilkan reaksi melalui energi pengaktifan. Contoh percobaan dan persamaan laju reaksi disertakan untuk memberikan gambaran yang jelas tentang konsep ini.Bab3kesetimbangankimiakelasxi 141109045950-conversion-gate02
Bab3kesetimbangankimiakelasxi 141109045950-conversion-gate02sanoptri
Ěý
Bab 4 membahas tentang kesetimbangan kimia, termasuk konsep kesetimbangan dinamis, reaksi reversibel dan irreversibel, serta faktor-faktor yang memengaruhi pergeseran kesetimbangan. Penjelasan juga mencakup tetapan kesetimbangan dan aplikasinya dalam industri, seperti pembuatan amonia dan asam sulfat. Selain itu, dijelaskan bagaimana perubahan konsentrasi, tekanan, suhu, dan penambahan katalis mempengaruhi kesetimbangan reaksi.Ad
Bab6larutanelektrolitkelasx 141109050211-conversion-gate02
- 1. BAB 6 LARUTAN ELEKTROLIT DAN KONSEP REDOKS 6.1 Larutan Elektrolit dan Nonelektrolit 6.2 Reaksi Redoks
- 2. Larutan Elektrolit dan Nonelektrolit Larutan dapat dibedakan atas: a. Larutan elektrolit, yaitu larutan yang dapat menghantarkan listrik b. Larutan nonelektrolit, yaitu larutan yang tidak dapat menghantarkan listrik Air tidak menghantarkan listrik (lampu pijar tidak menyala), sedangkan larutan HCl dan larutan NaOH menghantar listrik (lampu pijar menyala).
- 3. Teori Ion Svante Arrhenius Menurut Arrhenius, larutan elektrolit dapat menghantar listrik karena mengandung ion-ion yang dapat bergerak bebas. Ion-ion itulah yang menghantar arus listrik melalui larutan NaCl, HCl, NaOH, dan CH3COOH tergolong elektrolit. Zat-zat ini dalam air terurai menjadi ion-ion berikut. NaCl Na (aq) + Cl (aq) HCl(g) H (aq) + Cl (aq) NaOH(s) Na (aq) + OH (aq) CH3COOH(l) CH3COO (aq) + H (aq) Contoh: C2H5OH(l) C2H5OH(aq) etanol CO(NH2)(s) CO(NH2)2(aq) urea + - + - + - + -
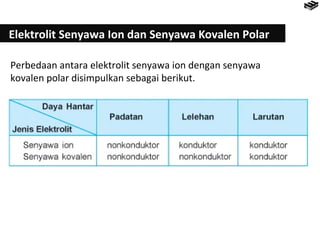
- 4. Elektrolit Senyawa Ion dan Senyawa Kovalen Polar Perbedaan antara elektrolit senyawa ion dengan senyawa kovalen polar disimpulkan sebagai berikut.
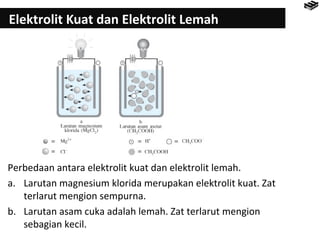
- 5. Elektrolit Kuat dan Elektrolit Lemah Perbedaan antara elektrolit kuat dan elektrolit lemah. a. Larutan magnesium klorida merupakan elektrolit kuat. Zat terlarut mengion sempurna. b. Larutan asam cuka adalah lemah. Zat terlarut mengion sebagian kecil.
- 6. Banyak-sedikitnya elektrolit yang mengion dinyatakan dengan derajat ionisasi atau derajat disosiasi (ἀ). • Jika semua zat yang dilarutkan mengion, maka derajat ionisasinya = 1 • Jikatidak ada yang mengion, maka derajat ionisasinya = 0. Zat elektrolit yang mempunyai derajat ionisasi besar (mendekati 1) kita sebut elektrolit kuat, sedangkan yang derajat ionisasinya kecil (mendekati 0) kita sebut elektrolit lemah.
- 7. Contoh: Elektrolit kuat: Larutan garam dapur (NaCl),larutan asam sulfat (H2SO4), larutan asam klorida (HCl), dan larutan natrium hidroksida. Elektrolit lemah: Larutan asam cuka (CH3COOH) dan larutan amonia (NH3).
- 8. Perkembangan Konsep Reduksi dan Oksidasi a. Oksidasi-Reduksi sebagai Pengikatan dan Pelepasan Oksigen - Oksidasi adalah pengikatan oksigen. - Reduksi adalah elepasan oksigen. - Sumber oksigen pada reaksi oksidasi disebut oksidator. - Zat yang menarik oksigen pada reaksi reduksi disebut reduktor. Gas metana bereaksi dengan oksigen menghasilkan panas yang dapat digunakan untuk memasak.
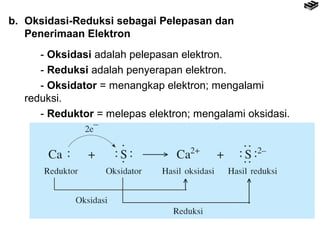
- 9. b. Oksidasi-Reduksi sebagai Pelepasan dan Penerimaan Elektron - Oksidasi adalah pelepasan elektron. - Reduksi adalah penyerapan elektron. - Oksidator = menangkap elektron; mengalami reduksi. - Reduktor = melepas elektron; mengalami oksidasi.
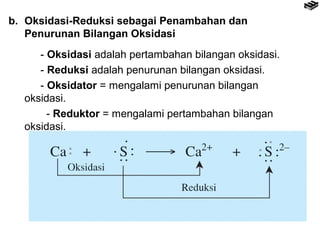
- 10. b. Oksidasi-Reduksi sebagai Penambahan dan Penurunan Bilangan Oksidasi - Oksidasi adalah pertambahan bilangan oksidasi. - Reduksi adalah penurunan bilangan oksidasi. - Oksidator = mengalami penurunan bilangan oksidasi. - Reduktor = mengalami pertambahan bilangan oksidasi.
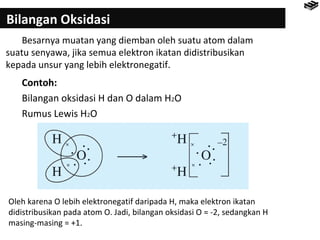
- 11. Bilangan Oksidasi Besarnya muatan yang diemban oleh suatu atom dalam suatu senyawa, jika semua elektron ikatan didistribusikan kepada unsur yang lebih elektronegatif. Contoh: Bilangan oksidasi H dan O dalam H2O Rumus Lewis H2O Oleh karena O lebih elektronegatif daripada H, maka elektron ikatan didistribusikan pada atom O. Jadi, bilangan oksidasi O = -2, sedangkan H masing-masing = +1.
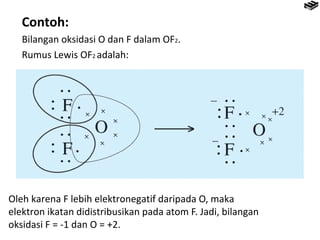
- 12. Contoh: Bilangan oksidasi O dan F dalam OF2. Rumus Lewis OF2 adalah: Oleh karena F lebih elektronegatif daripada O, maka elektron ikatan didistribusikan pada atom F. Jadi, bilangan oksidasi F = -1 dan O = +2.
- 13. Aturan Menentukan Bilangan Oksidasi 1. Unsur bebas mempunyai bilangan oksidasi = 0 2. Flourin, unsur yang paling elektronegatif dan membutuhkan 1 tambahan elektron, mempunyai bilangan oksidasi -1 pada semua senyawanya 3. Bilangan oksidasi unsur logam selalu bertanda positif. 4. Bilangan oksidasi suatu unsur dalam suatu ion tunggal sama dengan muatannya 5. Bilangan oksidasi H umumnya = +1, kecuali dalam senyawanya dengan logam, bilangan oksidasi H = -1 6. Bilangan oksidasi O umumnya = -2 7. Jumlah bilangan oksidasi unsur-unsur dalam suatu senyawa = 0 8. Jumlah bilangan oksidasi unsur-unsur dalam suatu ion poliatom = muatannya
- 14. Contoh Menentukan Bilangan Oksidasi a. CH4 : Bilangan oksidasi (b.o) H = +1 -4 +1 bilangan oksidasi b.o C + (4 x b.o H) = 0 C H4 b.o C + (4 x (+1)) = 0 -4 +4 jumlah bilangan Maka, b.o C = -4 oksidasi c. H2S2O7 : Bilangan oksidasi H = +1 Bilangan oksidasi O = -2 +1 +6 -2 (2 x (+1)) + (2 x b.o S) + (7 x (-2)) = 0 H2 S2 O7 2 x b.o S = +12 +2 +12 -14 Maka, b.o S = + 12 = +6 2 d. CrO7 : Bilangan oksidasi O = -2 +6 -2 (2 x b.o Cr) + (7 x (-2)) = -2 Cr2 O7 2 x b.o Cr = +12 +12 -14 Maka b.o Cr = +6 2- 2-
- 15. Reaksi Disproporsionasi dan Reaksi Konproporsionasi Reaksi disproporsionasi adalah reaksi redoks yang oksidator dan reduktornya merupakan zat yang sama. Jadi, sebagian dari zat itu mengalami oksidasi, dan sebagian lagi mengalami reduksi. Contoh: Reaksi antara klorin dengan larutan NaOH: 0 -1 +1 Cl2(g) + 2NaOH(aq) NaCl(aq) + NaClO(aq) + H2O(l) Reaksi disproporsionasi adalah reaksi redoks yang oksidator dan reduktornya merupakan zat yang sama. Jadi, sebagian dari zat itu mengalami oksidasi, dan sebagian lagi mengalami reduksi. Contoh: Reaksi antara klorin dengan larutan NaOH: -2 +4 0
- 16. Tata Nama IUPAC Banyak unsur yang dapat membentuk senyawa dengan lebih dari satu macam tingkat oksidasi. Salah satu cara yang disarankan IUPAC untuk membedakan adalah dengan menuliskan bilangan oksidasinya dalam tanda kurung dengan angka Romawi. Contoh: a. Senyawa ion Cu2S : tembaga(I) sulfida CuS : tembaga(II) sulfida c. Senyawa kovalen N2O : nitrogen(I) oksida N2O3 : nitrogen(III) oksida Namun demikian, tata nama senyawa kovalen biner yang lebih umum digunakan adalah dengan cara menyebutkan angka indeksnya. N2O : dinitrogen monoksida N2O3 : dinitrogen trioksida