Reaksi oksidasi-reduksi
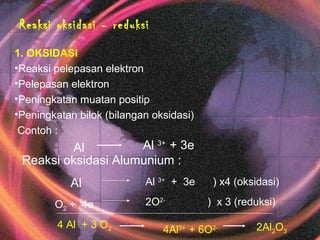
- 1. Reaksi oksidasi - reduksi 1. OKSIDASI •Reaksi pelepasan elektron •Pelepasan elektron •Peningkatan muatan positip •Peningkatan bilok (bilangan oksidasi) Contoh : Al Al 3+ + 3e Reaksi oksidasi Alumunium : Al Al 3+ + 3e ) x4 (oksidasi) O2 + 4e 2O2- ) x 3 (reduksi) 4 Al + 3 O2 4Al3+ + 6O2- 2Al2O3
- 2. REAKSI OKSIDASI REDUKSI 2. REAKSI REDUKSI  Reaksi penangkapan elektron  Penambahan muatan negatif  Penurunan bilangan oksidasi Contoh : o2 O2- + 2e Reaksi oksidasi selalu disertai reduksi dan disebut reaksi redoks Reaksi oksidasi atau reduksi saja secara terpisah disebut reaksi setengah (Half reaction)
- 3. OKSIDATOR DAN REDUKTOR OKSIDATOR : Zat yang mengoksidasi zat lain, tetapi zat Tersebut mengalami reaksi reduksi (penurunan bilok) Ciri-ciri oksidator:  Memiliki bilok tinggi  Dalam bentuk molekul maupun ion mudah mengikat elek tron  Dalam sistim periodik unsur ada di sebelah kanan Contoh : KMNO4 Mn bervalensi +7 K2Cr2O7 Cr bervalensi +6 KClO3 Cl bervalensi +5
- 4. OKSIDATOR DAN REDUKTOR Reduktor : zat yang mudah mereduksi zat lain, tetapi zat itu sendiri mengalami oksidasi (pening katan bilok) Ciri-ciri reduktor :  Memiliki bilok rendah  Dalam bentuk molekul maupun ion mudah melepaskan elektron  Dalam sistim periodik unsur, terletak di golongan : I, II, III,VI dan VII
- 5. OKSIDATOR DAN REDUKTOR Tabel Oksidator oksidator Elektron yg ditangkap Setelah reaksi Kondisi reaksi MnO4 MnO4- NO 3 - SO4 2- O2 ClO- CrO7 2- PbO2 5 3 1 2 4 2 6 2 Mn2+ MnO2 NO2 SO2 2O2- Cl- 2Cr3+ Pb2+ Larutan asam Netral atau basa Asam pekat Asam pekat Larutan asam
- 6. OKSIDATOR DAN REDUKTOR Tabel Reduktor Reduktor Elektron yang dilepas Setelah reaksi Kondisi reaksi NO2 S2- SO3 2- Fe2+ Sn2+ Cu Cl2 2I- 2 2 6 1 2 2 2 2 NO3 S SO2 Fe3+ Sn4+ Cu2+ 2ClO- I2 Dg oksidator kuat Larutan asam Larutan basa
- 7. BILANGAN OKSIDASI Syarat reaksi redoks : harus ada perubahan bilok BILANGAN OKSIDASI : Banyaknya muatan listrik dari unsur-unsur dalam suatu persenyawaan Peraturan-peraturan bilok : • Bilangan oksidasi satu unsur bebas = 0 • Bilangan oksidasi satu atom hidrogen = + 1 • Bilangan oksidasi satu atom oksigen = -2 • Bilangan oksidasi logam, selalu positip. Logam alkali selalu +1 dan alkali tanah selalu +2 • Jumlah bilok semua unsur dalam senyawa = 0
- 8. BILANGAN OKSIDASI Contoh : 1. SO2 Bilangan oksidasi SO2 = 0 Bilangan oksidasi 2 atom O = -4 Bilangan oksidasi S = +4 2. K2Cr2O7 Bilangan oksidasi K2Cr2O7 = 0 Bilangan oksidasi 2 atom K = +2 Bilangan oksidasi 7 atom O = -14 Bilangan oksidasi 1 atom Cr = +6
- 9. PENYETARAAN PERSAMAAN REDOKS Pengertian : Banyaknya elektron yang dilepaskan oleh reduktor harus sama dengan banyaknya elektron yang ditangkap oleh ok Sidator. 1. REAKSI SEDERHANA K + Cl2 Kcl Langkah-langkah : a. Cari perubahan bilok unsur-unsur b. Tulis reaksi oksidasi dan reduksi secara terpisah c. Kalikan masing-masing reaksi dengan bilangan tertentu untuk menyamakan elektron yang dilepas dan yang ditangkap
- 10. PENYETARAAN PERSAMAAN REDOKS d. Jumlahkan kedua reaksi tersebut Penyelesaian contoh : K K+ + 1e Cl2 + 2e 2Cl- ) x2 ) x1 2K 2K + 2e Cl2 + 2e 2 Cl- + + 2K + Cl2 2K + 2 Cl- 2 KCl
- 11. PENYETARAAN PERSAMAAN REDOKS 2. REAKSI DI LINGKUNGAN ASAM Syarat : harus diketahui perubahan biloknya. Contoh : Cu + HNO3 ? Cu Cu2+ (oksidasi) NO3 - NO (reduksi) LANGKAH-LANGKAH :  Tulis masing-masing reaksi oksidasi dan reduksi secara terpisah, lengkapi dengan perubahan elektron  Pihak yang kekurangan oksigen, ditambah H2O, yang kekurangan hidrogen tambahkan ion H+ . Sempurnakan masing masing reaksi  Kalikan masing-masing reaksi dengan bilangan tertentu untuk menyamakan jumlah elektron yang dilepas dan yang ditangkap
- 12. PENYETARAAN PERSAMAAN REDOKS  Jumlahkan kedua reaksi tersebut  Tulis hasil reaksi lengkap sesuai dengan zat yang bereaksi PENYELESAIAN CONTOH : Cu Cu2+ + 2e NO3 - + 3e NO Cu Cu2+ + 2e ) x 3 NO3 - + 3e + 4H+ NO + 2H2O ) x 2 +
- 13. PENYETARAAN PERSAMAAN REDOKS 3Cu 3Cu2+ + 6e 2NO3 - + 6e + 8H+ 2NO + 4H2O 3Cu + 2NO3 - + 8H+ 3Cu2+ + 2NO + 4H2O 3Cu + 8NO3 - + 8H+ 3Cu2+ + 2NO + 4H2O + 6NO3 - 8HNO3 3Cu + 3Cu (NO3)2 + 2NO + 2H2O
- 14. PENYETARAAN PERSAMAAN REDOKS 3. REAKSI DI LINGKUNGAN BASA Langkah –langkah : •Tulis masing-masing reaksi oksidasi dan reduksi secara terpisah, lengkapi dengan perubahan elektron •Pihak yang kekurangan oksigen, ditambah OH- , yang kekurangan hidrogen tambahkan ion H2O. Sempurnakan masing masing reaksi •Kalikan masing-masing reaksi dengan bilangan tertentu untuk menyamakan jumlah elektron yang dilepas dan yang ditangkap
- 15. PENYETARAAN PERSAMAAN REDOKS • Jumlahkan kedua reaksi tersebut • Tulis hasil reaksi lengkap sesuai dengan zat-zat yang bereaksi Contoh : NaCrO2 + Br2 + NaOH ? Diketahui : CrO2 - CrO4 2- Br2 Br- Penyelesaian : CrO2 - CrO4 2- + 3e Br2 + 2e 2Br -
- 16. PENYETARAAN PERSAMAAN REDOKS CrO2 - + 4OH - CrO4 2- + 3e Br2 + 2e 2Br - ) x3 + 2H2O ) x 2 2CrO2 - + 8OH - 2 CrO4 2- + 6e + 4H2O 3Br2 + 6e 6Br - + + 2 CrO2 - + 3Br2 + 8OH- 2CrO4 2- + 4H2O + 6Br- + 2Na+ + 8 Na+ + 4Na+ + 6Na+ 2NaCrO2 + 3Br2 + 8NaOH 2Na2CrO4 + 4H2O + 6NaBr
- 17. MENYEMPURNAKAN PERSAMAAN REDOKS (MENGISI KOEFISIEN REAKSI) Langkah-langkah : • Tentukan unsur-unsur yang mengalami perubahan bilok. Sertakan perubahan elektronnya. • Kalikan dengan bilangan tertentu untuk menyamakan jumlah elektron yang dilepas dan yang ditangkap. • Bilangan tersebut sebagai koefisien sementara. • Setarakan jumlah atom-atom, terutama H dan O di ruas kiri dan kanan.
- 18. MENYEMPURNAKAN PERSAMAAN REDOKS (MENGISI KOEFISIEN REAKSI) Cu + HNO3 Cu(NO3)2 + NO + H2O Penyelesaian : Cu Cu2+ + 2e ) x3 N5+ + 3e N2+ ) x2 3Cu + 2HNO3 3Cu(NO3)2 + 2NO + H2O 3Cu + 8HNO3 3Cu(NO3)2 + 2NO + 4H2O +
- 19. MENYEMPURNAKAN PERSAMAAN REDOKS (MENGISI KOEFISIEN REAKSI) LATIHAN SOAL : Isilah koefisien reaksi pada reaksi di bawah ini : KMnO4 + H2SO4 + FeSO4 K2SO4 + MnSO4 + Fe2(SO4)3 + H2O KMnO4 + H2SO4 + H2C2O4 K2SO4 + MnSO4 + CO2 + H2O Catatan : pada reaksi pembakaran zat organik menghasilkan CO2 dan H2O. Bilangan oksidasi C pada CO2 adalah : +4. Tetapi bilangan oksidasi C dalam zat organik kebanyakan kurang dari 4. Misal pada H2C2O4. Bilok C adalah +3