Halogen
- 2. SMA Kr. Kalam Kudus Malang Jln. Moh. Yamin no. 47 Malang
- 3. Perkenalan Unsur golongan VIIA ini merupakan unsur nonlogam paling reaktif. Unsur-unsur ini tidak ditemukan di alam dalam keadaan bebas, melainkan dalam bentuk garamnya. Oleh karena itu unsur-unsur nonlogam ini dinamakan HALOGEN, yang berasal dari kata halo genes (Bahasa Yunani) yang artinya pembentuk garam. Unsur nonlogam yang termasuk ke dalam golongan Halogen yaitu Fluor (F2), Klor (Cl2), Brom (Br2), Iodium (I2), dan Astatin (At2).
- 6. Fluorin
- 7. Klorin
- 8. Bromin
- 9. Astatin
- 11. Kelimpahan Unsur ŌĆóFluorin ’ā╝ CaF2 (Fluorspar), Na3AlF6(Kriolit), Ca5(PO4)F (Fluoroapatit), dalam gigi manusia dan hewan ŌĆóKlorin ’ā╝ Garam NaCl, KCl, MgCl2, dan CaCl dalam air laut ’ā╝ dalam kerak bumi ┬▒0,2% ŌĆóBromin ’ā╝ dalam senyawa logam bromida yang ditemukan di air laut mati, ’ā╝ mempunyai kadar 4.500 - 5.000 ppm
- 12. Kelimpahan Unsur ŌĆóIodin ’ā╝ dalam senyawa NaIO3 (Natrium iodat) yang bercampur dengan deposit NaNO di daerah Chili ’ā╝ dalam larutan garam bawah tanah di Jepang dan Amerikadengan kadar sampai 100 ppm ’ā╝ dalam sumber air di daerah Watudakon (Mojokerto) Jatim juga mengandung yodium dengan kadar cukup tinggi ’ā╝ beberapa jenis lumut, ganggang laut ŌĆóAstatin ’ā╝ dalam kerak bumi sangat sedikit, kurang dari 30 gram, sebab unsur ini bersifat radioaktif
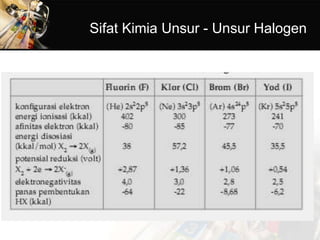
- 14. Sifat Fisika Unsur Halogen ŌĆó1) Warna dan bau Semua halogen berbau rangsang dan menusuk. Waktu kita menggunakan pemutih pakaian, kita mencium gas berbau rangsang yang dapat merusak saluran pernafasan, gas itu adalah gas klor. Semua gas halogen mempunyai warna tertentu, khusus untuk iodium mempunyai 2 warna yakni saat berupa zat padat berwarna hitam, tetapi saat berupa gas (karena menyublim) berwarna ungu.
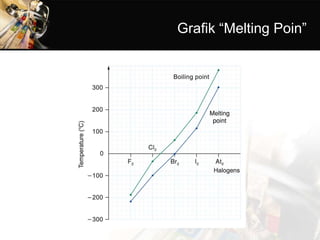
- 15. 2) Wujud halogen Molekul halogen (X2) bersifat nonpolar, gaya tarik antarmolekulnya merupakan gaya London. Gaya London akan semakin kuat bila massa molekul (Mr) semakin bertambah. Itulah sebabnya pada suhu kamar F2 dan Cl2 berwujud gas, Br2 berbentuk cair dan I2 berbentuk padat (tetapi mudah menyublim).
- 16. 3)Titik didih/titik lebur Titik didih dan titik lebur halogen dari F sampai I semakin besar. Ini disebabkan dari F sampai I massa molekulnya semakin bertambah sehingga gaya tarik antarmolekulnya bertambah kuat.
- 17. 4) Kelarutan Molekul halogen bersifat nonpolar, maka mudah larut dalam pelarut nonpolar, seperti karbon tetra klorida (CCl4) atau kloroform (CHCl3). Sebaliknya halogen ini sukar larut dalam pelarut polar seperti H2O. I2 sukar larut dalam air, tetapi mudah larut dalam larutan iodida (I-),membentuk poli Iodida (I3) yang mudah terurai kembali menjadi I2, sehingga larutan ini seperti larutan I2 biasa. I2(s) + I-(aq) ŌåÆ I3 -(aq)
- 19. Sifat Kimia Unsur - Unsur Halogen
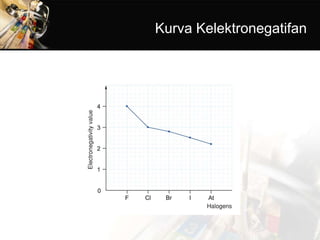
- 20. 1) Kereaktifan halogen Halogen yang mempunyai elektron valensi 7 menyebabkan sifat tidak stabil dan berusaha untuk menstabilkan diri dengan cara berikatan dengan atom lain. Halogen sangat reaktif sehingga unsur halogen tidak diketemukan dalam keadaan bebas di alam. Perhatikan jari- jari atom pada tabel, semakin kecil nomor atom unsur halogen, makin pendek jari-jari atomnya. Hal ini menyebabkan makin mudah atom itu untuk menangkap satu elektron dari luar, membentuk ion halida (X-). Semakin mudah menangkap elektron, makin reaktif unsur halogen tersebut. Kereaktifan Halogen Berkurang dari Fluor ke Astatin
- 21. 2) Daya oksidasi halogen Harga potensial elektroda golongan halogen positif, berarti bersifat oksidator (mengalami reduksi). Makin besar harga potensial elektroda makin bersifat oksidator. Unsur fluorin mempunyai potensial elektroda terbesar berarti fluorin paling mudah mengalami reduksi. Hal ini dapat ditunjukkan dalam reaksi pendesakan berikut. Dari contoh-contoh reaksi di atas dapat disimpulkan bahwa halogen yang daya oksidastornya besar (pada tabel SPU posisinya lebih atas) dapat mengoksidasi senyawa halida di bawahnya.Daya Oksidasi Halogen Berkurang dari Fluor dan Astatin
- 22. 3) Bilangan oksidasi halogen Pada senyawa hidrogen halida dan garam halida, halogen mempunyai biangan oksidasi -1. Garam- garam halida banyak kita jumpai dalam kehidupan sehari-hari misalnya NaCl, CaCl2, KI, dan lain- lain.Kecuali fluorin, unsur-unsur golongan halogen dapat mempunyai bilangan oksidasi positif. Klorin, Bromin dan Iodin dapat membentuk asam oksi dengan bilangan oksidasi +1, +3, +5, dan +7.
- 23. 4) Kekuatan asam -Asam halida Asam halida dari atas ke bawah semakin kuat: HF < HCl <HBr <HI Karena dari atas ke bawah jari-jari atom halogen makin besar sehingga ion H+ semakin mudah terlepas.
- 24. -Asam oksi halogen Asam oksi halogen dari atas ke bawah semakin lemah HClO > HBrO > HIO + 1 +1 +1 Karena dari atas ke bawah jari-jari atom halogen makin besar sehingga gaya tolak terhadap ion H+ semakin lemah.
- 25. 5) Titik didih hidrogen halida/asam halida Urutan titik didih hidrogen halida adalah: HCl <HBr < HI <HF Antarmolekul halida terdapat gaya dispersi, semakin besar massa molekul relatif, semakin kuat gaya dispersinya, sehingga akan menyebabkan titik didih senyawa semakin besar. HF mempunyai titik didih paling tinggi walaupun HF mempunyai massa molekul paling rendah dibanding hidrogen halida yang lain, karena antara molekul HF mempunyai ikatan hidrogen. Ikatan hidrogen lebih kuat jika dibanding dengan kekuatan gaya dispersi antarmolekul.
- 28. Pembuatan Unsur Halogen Halogen dapat dibuat dengan cara elektrolisis atau dengan cara mengoksidasi senyawa halida (X-). Pada umumnya unsur-unsur halogen (X2) dibuat di laboratorium dengan cara mengoksidasi senyawa halida. Gas fluorin (F2) jarang dibuat di laboratorium karena tidak ada oksidator yang mampu mengoksidasi senyawa fluorida (F). Mengapa demikian? Fluorin mempunyai daya oksidasi tinggi dibanding halogen yang lain. Unsur halogen klorin, bromin, dan iodin dapat dihasilkan dari oksidasi terhadap senyawa halida denganoksidator MnO2 atau KMnO4 dalam lingkungan asam.
- 29. Pembuatan Fluorin (F2) Fluorin diperoleh melalui proses elektrolisis garam hidrogen fluorida, KHF2 dilarutkan dalam HF cair, kemudian ditambahkan LiF 3% (agar suhu turun sampai ┬▒100oC). Elektrolisis dilakukan pada tempat terbuat dari baja, di mana sebagai katode baja dan sebagai anoda karbon (grafit).
- 30. Pembuatan Clorin (Cl2) Air laut dan garam batu merupakan sumber utama Cl, untuk mendapatkan Cl dapat dilakukan elektrolisis leburan NaCl, dan elektrolisis larutan NaCl.
- 31. Pembuatan Bromin (Br2) Air laut juga sumber utama Br. Setiap 1 m3 air laut terdapat 3 kg bromin (Br2). Bromin didapatkan dengan cara mengoksidasi ion bromida yang terdapat dalam air laut. Br2 dalam air dapat mengalami hidrolisis.
- 32. Pembuatan Iodin (I2) Yodium di alam hanya terdapat natrium yodat (NaIO3). Yodium dibuat secara reduksi ion yodat dengan produksi natrium hidrogen-sulfit.
- 34. Kegunaan Fluorin ŌĆó HF digunakan untuk mensketsa kaca karena HF bereaksi dengan kaca (SiO2), yaitu untuk membuat gambar pada gelas, ŌĆó membuat skala pada buret dan termometer 4HF + SiO2 ŌåÆ SiF4 + 2H2O. ŌĆó Sebagai lapisan antilengket pada panci teflon (polimer CF2 = CF2). ŌĆó Untuk pasta gigi (pasta gigi yang mengandung fluorida),Na2SiF6 (natrium heksafluorosilikat). ŌĆó Fluorin digunakan sebagai pendingin (CF2Cl2, CCIF3) Bisa juga disebut Freon.
- 35. Kegunaan Clorida ’ā╝Kapur klor (CaOCl2) digunakan sebagai serbuk pemutih/pengelantang. ’ā╝Kaporit Ca (OCl)2, sebagai disinfektan, digunakan pada pengolahan air minum untuk membunuh bakteri. ’ā╝Natrium hipoklorit (NaClO) sebagai pemutih tepung. ’ā╝Natrium klorida (NaCl) digunakan sebagai penyedap dan pengawet makanan. ’ā╝Kalium klorat (KClO ) digunakan sebagai
- 36. ’ā╝Atenrin (C23H30CN3Cl) sebagai obat malaria. ’ā╝DDT (diklor difenil triklor etana) sebagai bahan pestisida. ’ā╝Sengklorida (ZnCl2) sebagai bahan pematri (solder). ’ā╝Amonium klorida (NH4Cl) sebagai elektrolit pengisi batu baterai. ’ā╝Bahan baku pembuat plastik PVC (CH2CHCl).
- 37. Kegunaan Bromin ’ā╝ Bromin dalam benuk Natrium Bromide (NaBr), berfungsi sebagai obat penenang syaraf ’ā╝ Unsur Bromin dalam senyawa Perak Bromide (AgBr) Berguna dalam seni fotografi disuspensikan dalam gelatin untuk film fotografi. ’ā╝ Fungsi Bromin dalam Metil Bromide (CH3Br) berguna sebagai zat pemadam kebakaran
- 38. Kegunaan Iodin ’üČIodin dalam obat merah digunakan sebagai antiseptik ’üČDalam laboratorium digunakan sebagai pengidentifikasi adanya amilum. ’üČIodin dalam bentuk kalium Iodat (KKIO3) sebagai pencegah penyakit gondok
- 39. Astatin ŌĆó Astattin Merupakan bahan Radioaktif