1 of 14
Downloaded 14 times







![Elektron valensi
Merupakan jumlah elektron pada kulit terluar yang
menunjukkan golongannya ( untuk golongan
utama). Elektron valensi sangat menentukan
sifat-sifat kimia suatu unsur.
Contoh : 20 Ca
20 Ca
: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 atau [ 18 Ar ] 4S 2
Kulit terluar n = 4, pada orbital s ada 2 elektron, jadi lektron
valensi Ca = 2
Berapa elektron valensi :
a.
35 Br
b.
13 Al
c.
37 Rb](https://image.slidesharecdn.com/penggambaranorbitalmolekul-140309151703-phpapp02/85/orbital-molekul-13-320.jpg)

Recommended
Tugas 3 Praktikum Matlab



Tugas 3 Praktikum MatlabEla Nuryani
Ã˝
Dokumen tersebut menjelaskan tentang perhitungan volume molar uap dan cair n-butana pada suhu 350 K dan tekanan uap 9.4573 bar menggunakan persamaan Redlich-Kwong-Soave. Persamaan tersebut dibentuk menjadi persamaan polinomial ketiga untuk dihitung.Konfigurasi elektron [SMA kelas 10 / Belajar mandiri]![Konfigurasi elektron [SMA kelas 10 / Belajar mandiri]](https://cdn.slidesharecdn.com/ss_thumbnails/konfigsubkulit-200430070648-thumbnail.jpg?width=560&fit=bounds)
![Konfigurasi elektron [SMA kelas 10 / Belajar mandiri]](https://cdn.slidesharecdn.com/ss_thumbnails/konfigsubkulit-200430070648-thumbnail.jpg?width=560&fit=bounds)
![Konfigurasi elektron [SMA kelas 10 / Belajar mandiri]](https://cdn.slidesharecdn.com/ss_thumbnails/konfigsubkulit-200430070648-thumbnail.jpg?width=560&fit=bounds)
![Konfigurasi elektron [SMA kelas 10 / Belajar mandiri]](https://cdn.slidesharecdn.com/ss_thumbnails/konfigsubkulit-200430070648-thumbnail.jpg?width=560&fit=bounds)
Konfigurasi elektron [SMA kelas 10 / Belajar mandiri]Louis W
Ã˝
Dokumen tersebut membahas tentang konfigurasi elektron atom menurut teori Bohr dan aturan Aufbau, Pauli, Hund, serta penuh dan setengah penuh. Terdapat penjelasan tentang subkulit, bilangan kuantum, dan cara menentukan golongan dan periode unsur serta perubahan konfigurasi elektron pada ion.1 konfigurasi elektron



1 konfigurasi elektronSinCosTan5
Ã˝
Dokumen tersebut membahas tentang konfigurasi elektron pada atom, yang merupakan susunan elektron-elektron pada orbital-orbital dalam atom. Dibahas pula aturan pengisian elektron ke dalam orbital seperti asas Aufbau, larangan Pauli, dan kaidah Hund. Juga dibahas mengenai notasi dan penulisan konfigurasi elektron serta faktor-faktor yang mempengaruhi stabilitas atom.1 2 struktur atom dan sistem periodik unsur



1 2 struktur atom dan sistem periodik unsurSinCosTan5
Ã˝
Dokumen tersebut membahas tentang struktur atom dan sistem periodik unsur. Teori atom berkembang dari model bola pejal Dalton hingga model modern dengan konsep inti atom, elektron, dan bilangan kuantum. Unsur-unsur dikelompokkan dalam sistem periodik berdasarkan nomor atom dan sifat kimia berkala. Sifat-sifat seperti jari-jari, energi ionisasi, dan keelektronegatifan memiliki pola berkala sepanjang periode dan golongSel dalam praktek, presentasi kimia. tris h (41612010025), anissa a (41612010...



Sel dalam praktek, presentasi kimia. tris h (41612010025), anissa a (41612010...mercu buana university
Ã˝
Sel volta ipa 1



Sel volta ipa 1ressa comunity
Ã˝
Dokumen tersebut membahas tentang berbagai jenis baterai/sel kering, yaitu:
1. Sel Leclanché yang terdiri atas logam seng, karbon, dan larutan MnO2 dan NH4Cl.
2. Sel kering alkali yang menggunakan KOH atau NaOH sebagai pengganti NH4Cl untuk meningkatkan umur baterai.
3. Baterai nikel-kadmium yang mirip dengan baterai timbal dan dapat dibuat lebih kecil untuk alatKuis k dasar kelas j



Kuis k dasar kelas jBranikoOctrado
Ã˝
Tes kimia dasar ini berisi 7 soal yang meliputi konfigurasi elektron unsur kimia, struktur molekul senyawa organik dan anorganik, reaksi kimia termasuk reaksi adisi dan pembakaran, perhitungan persentase komposisi, serta perhitungan hasil reaksi berdasarkan reaksi kimia dan persamaan stoikiometri.Tugas sel volta dalam kehidupan sehari hari



Tugas sel volta dalam kehidupan sehari hariYouta-Icha S-Saeng
Ã˝
1. Sel volta digunakan dalam berbagai peralatan listrik seperti radio, televisi, dan kendaraan. Jenis sel volta yang umum digunakan adalah sel baterai, sel aki, dan sel bahan bakar.
2. Sel baterai mengandalkan reaksi kimia antara logam dan elektrolit untuk menghasilkan arus listrik. Sel aki dapat diisi ulang setelah kehabisan daya.
3. Sel volta dapat digunakan dalam berbagai proses seKelas 12 ipa 010 the faraday law



Kelas 12 ipa 010 the faraday lawElizabeth Indah P
Ã˝
Perhitungan Hukum Faraday I dan II pada sel elektrolisisKimia - Redoks - Hukum Faraday



Kimia - Redoks - Hukum FaradayHendro Hartono
Ã˝
Dokumen tersebut membahas tentang hukum Faraday yang menyatakan bahwa massa zat yang dihasilkan pada elektrolisis berbanding lurus dengan jumlah muatan listrik yang digunakan dan massa ekuivalen zat tersebut. Dokumen ini juga berisi contoh soal penerapan hukum Faraday dalam menghitung massa logam atau volume gas yang dihasilkan pada elektrolisis berdasarkan arus listrik, waktu, dan berat atom zat terkait.Bentuk molekul



Bentuk molekulZainal Abidin
Ã˝
Dokumen tersebut membahas tentang bentuk struktur molekul, yang mencakup penjelasan tentang berbagai bentuk geometri molekul seperti linier, segitiga, tetrahedron, dan lainnya yang ditentukan oleh sudut ikatan antaratom dan jenis ikatan elektronnya. Dokumen ini juga menjelaskan teori domain elektron dan hibridisasi orbital yang dapat digunakan untuk memprediksi bentuk molekul.Contoh sel volta dalam kehidupan seharihari



Contoh sel volta dalam kehidupan seharihariDheaz Anugrah Bakhtiar
Ã˝
Sel volta adalah sel elektrokimia yang menghasilkan arus listrik dan terdiri dari anoda dan katoda. Sel volta digunakan dalam banyak perangkat seperti baterai dan aki yang berbeda dalam hal apakah dapat diisi ulang atau tidak. Ada tiga jenis sel volta yaitu primer, sekunder, dan bahan bakar.Latihan soal bil. kuantum



Latihan soal bil. kuantumKalderizer
Ã˝
Dokumen tersebut berisi soal-soal latihan mengenai teori atom, bilangan kuantum, dan konfigurasi elektron. Terdapat 10 pertanyaan yang mencakup topik subkulit, jenis bilangan kuantum, jumlah elektron tidak berpasangan pada ion, konfigurasi elektron unsur dan ion, perbedaan model atom Bohr dan mekanika kuantum, jenis orbital, bilangan kuantum yang dilarang, konfigurasi elektron ion, alasan jumlah unsur berbeda padaKIMIA KONFIGURASI ELEKTRON DAN SEMACAMNYA



KIMIA KONFIGURASI ELEKTRON DAN SEMACAMNYAchrestoezra
Ã˝
Dokumen ini membahas tentang struktur atom dan sistem periodik. Topik utama yang dibahas adalah orbital atom, bilangan kuantum, konfigurasi elektron, diagram orbital, golongan dan periode dalam sistem periodik, serta latihan soal untuk memahami konsep-konsep tersebut.konfigurasi elektron berdasarkan teori bohr dan mekanika kuantum



konfigurasi elektron berdasarkan teori bohr dan mekanika kuantumsriyeni20binarkh
Ã˝
penjelasan tentang konfigurasi elektron baik secara mekanika kuantum maupun bohrBab2 struktur atom



Bab2 struktur atomnali_tigan
Ã˝
Dokumen tersebut membahas model-model atom dari Dalton hingga mekanika kuantum beserta bilangan-bilangan kuantum dan konfigurasi elektronnya. Terdapat informasi tentang partikel penyusun atom, model-model atom klasik, bilangan-bilangan kuantum, dan aturan-aturan pengisian elektron dalam orbital atom.More Related Content
What's hot (14)
Sel dalam praktek, presentasi kimia. tris h (41612010025), anissa a (41612010...



Sel dalam praktek, presentasi kimia. tris h (41612010025), anissa a (41612010...mercu buana university
Ã˝
Sel volta ipa 1



Sel volta ipa 1ressa comunity
Ã˝
Dokumen tersebut membahas tentang berbagai jenis baterai/sel kering, yaitu:
1. Sel Leclanché yang terdiri atas logam seng, karbon, dan larutan MnO2 dan NH4Cl.
2. Sel kering alkali yang menggunakan KOH atau NaOH sebagai pengganti NH4Cl untuk meningkatkan umur baterai.
3. Baterai nikel-kadmium yang mirip dengan baterai timbal dan dapat dibuat lebih kecil untuk alatKuis k dasar kelas j



Kuis k dasar kelas jBranikoOctrado
Ã˝
Tes kimia dasar ini berisi 7 soal yang meliputi konfigurasi elektron unsur kimia, struktur molekul senyawa organik dan anorganik, reaksi kimia termasuk reaksi adisi dan pembakaran, perhitungan persentase komposisi, serta perhitungan hasil reaksi berdasarkan reaksi kimia dan persamaan stoikiometri.Tugas sel volta dalam kehidupan sehari hari



Tugas sel volta dalam kehidupan sehari hariYouta-Icha S-Saeng
Ã˝
1. Sel volta digunakan dalam berbagai peralatan listrik seperti radio, televisi, dan kendaraan. Jenis sel volta yang umum digunakan adalah sel baterai, sel aki, dan sel bahan bakar.
2. Sel baterai mengandalkan reaksi kimia antara logam dan elektrolit untuk menghasilkan arus listrik. Sel aki dapat diisi ulang setelah kehabisan daya.
3. Sel volta dapat digunakan dalam berbagai proses seKelas 12 ipa 010 the faraday law



Kelas 12 ipa 010 the faraday lawElizabeth Indah P
Ã˝
Perhitungan Hukum Faraday I dan II pada sel elektrolisisKimia - Redoks - Hukum Faraday



Kimia - Redoks - Hukum FaradayHendro Hartono
Ã˝
Dokumen tersebut membahas tentang hukum Faraday yang menyatakan bahwa massa zat yang dihasilkan pada elektrolisis berbanding lurus dengan jumlah muatan listrik yang digunakan dan massa ekuivalen zat tersebut. Dokumen ini juga berisi contoh soal penerapan hukum Faraday dalam menghitung massa logam atau volume gas yang dihasilkan pada elektrolisis berdasarkan arus listrik, waktu, dan berat atom zat terkait.Bentuk molekul



Bentuk molekulZainal Abidin
Ã˝
Dokumen tersebut membahas tentang bentuk struktur molekul, yang mencakup penjelasan tentang berbagai bentuk geometri molekul seperti linier, segitiga, tetrahedron, dan lainnya yang ditentukan oleh sudut ikatan antaratom dan jenis ikatan elektronnya. Dokumen ini juga menjelaskan teori domain elektron dan hibridisasi orbital yang dapat digunakan untuk memprediksi bentuk molekul.Contoh sel volta dalam kehidupan seharihari



Contoh sel volta dalam kehidupan seharihariDheaz Anugrah Bakhtiar
Ã˝
Sel volta adalah sel elektrokimia yang menghasilkan arus listrik dan terdiri dari anoda dan katoda. Sel volta digunakan dalam banyak perangkat seperti baterai dan aki yang berbeda dalam hal apakah dapat diisi ulang atau tidak. Ada tiga jenis sel volta yaitu primer, sekunder, dan bahan bakar.Latihan soal bil. kuantum



Latihan soal bil. kuantumKalderizer
Ã˝
Dokumen tersebut berisi soal-soal latihan mengenai teori atom, bilangan kuantum, dan konfigurasi elektron. Terdapat 10 pertanyaan yang mencakup topik subkulit, jenis bilangan kuantum, jumlah elektron tidak berpasangan pada ion, konfigurasi elektron unsur dan ion, perbedaan model atom Bohr dan mekanika kuantum, jenis orbital, bilangan kuantum yang dilarang, konfigurasi elektron ion, alasan jumlah unsur berbeda padaSel dalam praktek, presentasi kimia. tris h (41612010025), anissa a (41612010...



Sel dalam praktek, presentasi kimia. tris h (41612010025), anissa a (41612010...mercu buana university
Ã˝
Similar to orbital molekul (20)
KIMIA KONFIGURASI ELEKTRON DAN SEMACAMNYA



KIMIA KONFIGURASI ELEKTRON DAN SEMACAMNYAchrestoezra
Ã˝
Dokumen ini membahas tentang struktur atom dan sistem periodik. Topik utama yang dibahas adalah orbital atom, bilangan kuantum, konfigurasi elektron, diagram orbital, golongan dan periode dalam sistem periodik, serta latihan soal untuk memahami konsep-konsep tersebut.konfigurasi elektron berdasarkan teori bohr dan mekanika kuantum



konfigurasi elektron berdasarkan teori bohr dan mekanika kuantumsriyeni20binarkh
Ã˝
penjelasan tentang konfigurasi elektron baik secara mekanika kuantum maupun bohrBab2 struktur atom



Bab2 struktur atomnali_tigan
Ã˝
Dokumen tersebut membahas model-model atom dari Dalton hingga mekanika kuantum beserta bilangan-bilangan kuantum dan konfigurasi elektronnya. Terdapat informasi tentang partikel penyusun atom, model-model atom klasik, bilangan-bilangan kuantum, dan aturan-aturan pengisian elektron dalam orbital atom.758885105-struktur-atom1.ppt



758885105-struktur-atom1.pptbagus47141
Ã˝
Dokumen tersebut membahas perkembangan teori atom, mulai dari model atom Thomson, Rutherford, hingga Bohr. Model Thomson mengasumsikan atom berbentuk bola dengan muatan positif dan elektron bermuatan negatif tersebar di dalamnya. Eksperimen Rutherford menemukan adanya inti atom. Model Bohr menyatakan elektron dapat berada pada orbit-orbit tertentu di sekitar inti. Teori ini mampu menjelaskan spektrum atom hidrogen.758885105-struktur-atom1.ppt



758885105-struktur-atom1.pptdepanbelakang0704
Ã˝
Dokumen tersebut membahas perkembangan teori atom, mulai dari model Thomson, Rutherford, hingga Bohr. Model Thomson mengasumsikan atom berbentuk bola dengan muatan positif dan elektron bermuatan negatif tersebar di dalamnya. Eksperimen Rutherford menemukan adanya inti atom. Model Bohr menyatakan elektron dapat berada pada orbit-orbit tertentu di sekitar inti. Teori ini mampu menjelaskan spektrum atom hidrogen.D:\Tugas\Semester6\Pembelajaran Elektronik\Yeni Raini



D:\Tugas\Semester6\Pembelajaran Elektronik\Yeni Rainiguest88704e
Ã˝
Dokumen tersebut membahas tentang struktur atom dan konfigurasi elektron. Ia menjelaskan bilangan kuantum utama, azimuth, magnetik, dan spin yang menentukan bentuk dan orientasi orbital elektron. Dokumen juga menjelaskan aturan pengisian elektron menurut prinsip Aufbau dan Hund serta hubungannya dengan tabel periodik unsur.Bab2 struktur atom



Bab2 struktur atomrestuputraku5
Ã˝
Dokumen tersebut membahas tentang struktur atom, mulai dari partikel penyusun atom seperti elektron, proton, dan neutron. Kemudian dibahas model-model atom seperti model atom Dalton, Thomson, Rutherford, Bohr, dan mekanika kuantum. Juga dibahas tentang bilangan-bilangan kuantum yang menentukan kedudukan elektron dalam atom, konfigurasi elektron, dan beberapa istilah lain seperti isotop, isobar, dan isoton.Konfigurasi elektron



Konfigurasi elektronAndi Rahim
Ã˝
Bab ini membahas tentang konfigurasi elektron atom, yang mencakup bilangan kuantum, orbital atom, muatan inti efektif, aturan penempatan elektron seperti larangan Pauli, prinsip Aufbau, dan aturan Hund. Bab ini juga menjelaskan hubungan antara konfigurasi elektron dengan sistem periodik unsur untuk menentukan letak suatu unsur.KONFIGURASI ELEKTRON



KONFIGURASI ELEKTRONMadrasahAliyahPandan
Ã˝
Dokumen tersebut membahas model atom Niels Bohr dan konfigurasi elektron menurut mekanika kuantum, termasuk aturan pengisian elektron (Aufbau), larangan Pauli, dan aturan Hund. Juga dibahas penulisan konfigurasi elektron, diagram orbital, dan beberapa penyimpangan dari aturan umum konfigurasi elektron.More from Dede Suhendra (12)
Laporan praktikum kimfis kel ix



Laporan praktikum kimfis kel ixDede Suhendra
Ã˝
Laporan praktikum ini membahas kinetika reaksi redoks dengan menentukan orde reaksi dan konstanta laju reaksi dari dua jenis garam yang berbeda ukuran partikelnya. Hasilnya menunjukkan bahwa garam halus memiliki orde reaksi 0,68 dan konstanta laju 0,0115-1, sedangkan garam kasar orde reaksi 0,48 dan konstanta laju 0,0075-1. Kelarutan garam dipengaruhi oleh ukuran partikelLaporan praktikum kimia fisika i perc. viii 



Laporan praktikum kimia fisika i perc. viii Dede Suhendra
Ã˝
Laporan praktikum ini bertujuan untuk menentukan tingkat keasaman zat berpori seperti lempung dan arang dengan menggunakan metode titrasi. Hasilnya menunjukkan bahwa pada suasana asam, konsentrasi HCl untuk lempung adalah 0,08 N sedangkan untuk arang adalah 0,1 N. Pada suasana basa, konsentrasi NaOH untuk lempung adalah 0,03 N sedangkan untuk arang adalah 0,05 N. Dengan kataDiagram tiga komponen 



Diagram tiga komponen Dede Suhendra
Ã˝
Dokumen tersebut membahas sistem tiga komponen air, kloroform, dan asam asetat. Bertujuan untuk memberikan data kelarutan ketiga komponen dan mengetahui derajat kebebasan sistemnya. Data kelarutan diperoleh dengan menitrasi campuran air dan asam asetat dengan kloroform atau air. Hasilnya digambarkan dalam diagram segitiga untuk mengetahui variasi komposisi ketiga komponen.Tegangan permukaan 



Tegangan permukaan Dede Suhendra
Ã˝
Laporan praktikum ini membahas percobaan tegangan permukaan yang bertujuan untuk menentukan berbagai tegangan permukaan cairan dengan metode kenaikan pipa kapiler. Pada percobaan diperoleh data kenaikan cairan dalam pipa kapiler pada berbagai suhu untuk menghitung tegangan permukaannya. Hasilnya adalah tegangan permukaan air 70,1 dyne/cm pada 40°C dan 68,2 dyne/cm pada 50°C.Destilation of biner solution 



Destilation of biner solution Dede Suhendra
Ã˝
Destilasi digunakan untuk memisahkan bahan kimia berdasarkan titik didihnya. Tujuan eksperimen ini adalah untuk mempelajari prinsip destilasi dengan memanaskan larutan biner sehingga zat dengan titik didih rendah akan menguap terlebih dahulu. Hasilnya menunjukkan suhu bertambah seiring penambahan air.Laporan kimfis 1 kelompok i 



Laporan kimfis 1 kelompok i Dede Suhendra
Ã˝
Laporan praktikum menentukan berat molekul senyawa berdasarkan pengukuran massa jenis gas. Metode yang digunakan adalah penguapan, pendinginan, dan pengeringan kloroform. Berat molekul kloroform diperoleh sebesar 42743,976 gram/mol.Model ikatan kimia 



Model ikatan kimia Dede Suhendra
Ã˝
Dokumen tersebut membahas berbagai model ikatan kimia antara atom-atom, meliputi ikatan ionik yang terjadi karena transfer elektron, ikatan kovalen yang terjadi karena sharing elektron, dan ikatan logam yang terjadi karena pembentukan pita elektron. Dibahas pula konsep elektronegativitas dan polaritas ikatan, serta sifat-sifat yang ditimbulkan oleh masing-masing jenis ikatan tersebut.ikatan kimia



ikatan kimiaDede Suhendra
Ã˝
Ikatan kimia terjadi karena gaya tarik antaratom yang membentuk senyawa yang lebih kompleks. Terdapat dua jenis ikatan utama, yaitu ikatan ionik dan kovalen. Ikatan ionik terjadi antara ion positif dan negatif, sedangkan ikatan kovalen melibatkan pemakaian elektron bersama antaratom. Teori ikatan valensi menjelaskan pembentukan ikatan melalui overlapping orbital antaratom.Recently uploaded (20)
PROSES PERHITUNGAN IKU tahun 2024 untuk perguruan tinggi akademik dan vokasi.pdf



PROSES PERHITUNGAN IKU tahun 2024 untuk perguruan tinggi akademik dan vokasi.pdfIndra Diputra
Ã˝
Pedoman perhitungan IKURestrukturisasi dan Redistribusi Ekonomi melalui Danantara: Pesimis atau Opti...



Restrukturisasi dan Redistribusi Ekonomi melalui Danantara: Pesimis atau Opti...Dadang Solihin
Ã˝
Dari perspektif optimis, Danantara dapat menjadi pilar utama dalam pembangunan ekonomi nasional. Dengan manajemen profesional dan tata kelola yang transparan, lembaga ini berpotensi mengoptimalkan pemanfaatan aset negara secara lebih produktif. 1 Auditing II-Power Point AUDIT SIKLUS PENJUALAN DAN PENAGIHAN: PENGUJIAN PEN...



1 Auditing II-Power Point AUDIT SIKLUS PENJUALAN DAN PENAGIHAN: PENGUJIAN PEN...nhkfadhilah
Ã˝
1 Auditing II-Power Point.pptxPergub No. 59 Tahun 2023 - RP3KP PROV NTB 2023-2043.pdf



Pergub No. 59 Tahun 2023 - RP3KP PROV NTB 2023-2043.pdfWEST NUSA TENGGARA
Ã˝
Pergub No. 59 Tahun 2023 - RP3KP 2023-2043.pdfpertemuan 11 new- asuhan komunitas 2025.pptx



pertemuan 11 new- asuhan komunitas 2025.pptxAyiDamayani
Ã˝
Identifikasi masalah, prioritas masalah dan penyebab masalahKisi-kisi Ujian Praktik Bahasa Indonesia SD-MI (Websiteedukasi.com).docx



Kisi-kisi Ujian Praktik Bahasa Indonesia SD-MI (Websiteedukasi.com).docxAnohSuhaemi
Ã˝
KISI KISI UJIAN PRAKTIK BAHASA INDONESIA SDKisi- kisi Ujian Madrasah Baha Indonesia 2025.docx



Kisi- kisi Ujian Madrasah Baha Indonesia 2025.docxKhusnulAzizah4
Ã˝
kisi kisi ujian madrasah bahasa indonesiaMasukan untuk Peta Jalan Strategis Keangkasaan Indonesia



Masukan untuk Peta Jalan Strategis Keangkasaan IndonesiaDadang Solihin
Ã˝
Tujuan penyusunan naskah masukan untuk peta jalan strategis keangkasaan Indonesia ini adalah untuk meningkatkan kedaulatan dan pemanfaatan wilayah angkasa Indonesia dalam rangka memperkuat Ketahanan Nasional dan Visi Indonesia Emas 2045.Energy Efficiency & Sustainable Maintenance _Training *Proactive BUILDING MAI...



Energy Efficiency & Sustainable Maintenance _Training *Proactive BUILDING MAI...Kanaidi ken
Ã˝
Narasumber/ Pemateri Training: Kanaidi, SE., M.Si., cSAP., CBCM
HP/Wa Kanaidi: 0812 2353 284,
e-mail : kanaidi63@gmail.com
---------------------------------------- Chapter 3 - Network Thread and Attack Najib Muhammad



Chapter 3 - Network Thread and Attack Najib MuhammadUniversitas Teknokrat Indonesia
Ã˝
Chapter 3 - Network Thread and Attack.pptxBUNGAI JAKU SEMPAMA dikena bala pengajar Iban nyadika malin dalam ngajar.



BUNGAI JAKU SEMPAMA dikena bala pengajar Iban nyadika malin dalam ngajar.SantaMartina2
Ã˝
∫›∫›fl£ tu digaga Pengajar Medan Ak Radin lalu dikunsi ba ditu nyadika malin bala pengajar ti begunaka kereban senentang Jaku Iban. Info PELAKSANAAN + Link2 MATERI Training "Teknik Perhitungan dan Verifikasi T...



Info PELAKSANAAN + Link2 MATERI Training "Teknik Perhitungan dan Verifikasi T...Kanaidi ken
Ã˝
bagi Para Karyawan *PT. Tri Hasta Karya (Cilacap)* yang diselenbggarakan di *Hotel H! Senen - Jakarta*, 24-25 Februari 2025.
-----------
Narasumber/ Pemateri Training: Kanaidi, SE., M.Si., cSAP., CBCM
HP/Wa Kanaidi: 0812 2353 284,
e-mail : kanaidi63@gmail.com
---------------------------------------- orbital molekul
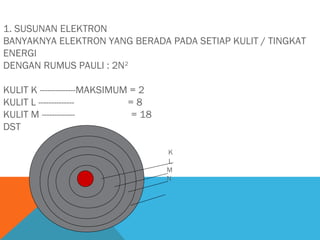
- 2. 1. SUSUNAN ELEKTRON BANYAKNYA ELEKTRON YANG BERADA PADA SETIAP KULIT / TINGKAT ENERGI DENGAN RUMUS PAULI : 2N2 KULIT K --------------MAKSIMUM = 2 KULIT L -------------=8 KULIT M ------------= 18 DST K L M N
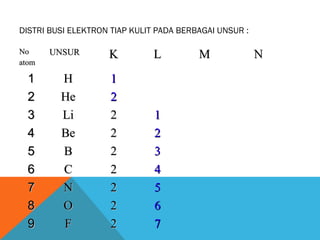
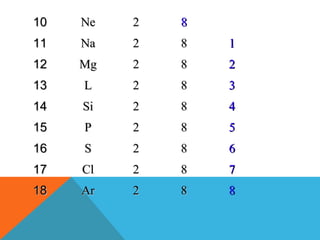
- 3. DISTRI BUSI ELEKTRON TIAP KULIT PADA BERBAGAI UNSUR : No atom 1 2 3 4 5 6 7 8 9 UNSUR H He Li Be B C N O F K L 1 2 2 2 2 2 2 2 2 1 2 3 4 5 6 7 M N
- 5. Isotop Unsur yg mempunyai nomor atom sama tetapi massa berbeda Contoh ; Hidrogen ( H-1; H-2 ; H-3 ) Karbon ( C- 12 ; C – 13 ) Oksigen ( O-16; O-17; O-18 ) Isobar Unsur yang mempunyai massa sma tetapi nomor atom berbeda. Contoh : N-14 dengn C-14 H -3 dengan He-3 Isoton Atom unsur-unsur yg memp. Jumlah netron yg sama: C-14 dan N-15 Iso elektron Atom/ ion yg mempunyai jumlah elektron yg sama Na + dan Ne ( 11Na + dan 10 Ne )
- 6. BEBERAPA NAMA UNSUR DENGAN SIMBOLNYA Lithium Kalium Magnesium Calsium Ferrum Cuprum Zink Chlor Oxygen Carbon Phospor Litium Kalium Magnsium Kalsium Besi Tembaga Zeng Klor Oksigen Karbon fosfor Li K Mg Ca Fe Cu Zn Cl O C P
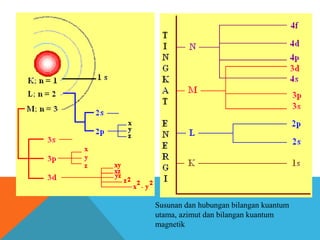
- 7. . . Susunan dan hubungan bilangan kuantum utama, azimut dan bilangan kuantum magnetik
- 8. . Sub tingkat Energi . (Orbital) S p d f g Jumlah Elektron Maksimum 2 6 10 14 18
- 9. Penggambaran orbital s dan orbital yang masing -masing memiliki satu pasang elektron. S2 px py pz Pengisian elektron diawali pada tingkat energi terendah yaitu orbital 1s, dilanjutkan pada orbital 2s, karena jumlah elektron yang tersisa 2 buah, maka elektron akan mengisi orbital 2px, dilanjutkan dengan orbital 2py, mengikuti aturan Hund. Untuk mempermudah membuat konfigurasi elektron dalam sebuah atom dapat dipergunakan bagan pengisian elektron sebagaimana ditampilkan pada Gambar
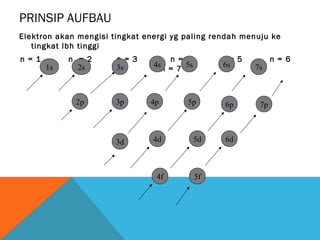
- 10. PRINSIP AUFBAU Elektron akan mengisi tingkat energi yg paling rendah menuju ke tingkat lbh tinggi n = 1 1s n = 2 2s 2p n = 3 3s 3p 3d n = 4 4s 5s n = 7 4p n = 5 6s 5p 4d 5d 4f 5f 6p 6d 7s 7p n = 6
- 11. Jadi urutan pengisian orbital adalah : 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p Mengapa pengisian 3d setelah 4s ?--- ternyata 4s mempunyai tingkat lebih rendah dari 3d ( 4s lbh dekat dg inti atom ) Contoh : 21 Sc artinya Sc nomor atom 21, jd jumlah elektron 21. pada tiap orbit diisikan elektron maksimum lbh dulu dan ditulis sbg pangkatnya. 21 Sc : Kulit 1S2 2S2 2p6 3s2 3p6 3d1 4s2 K Jmlh elektron: 2 L M N 8 9 2
- 12. DENGAN MENGHITUNG JUMLAH SUB KULIT MAKA DAPAT DIHITUNG JUMLAH ELEKTRON MAKSIMUM PADA TIAP KULIT : RUMUS JUMLAH ORBITAL = N 2 JUMLH ELEKTRON MAKS = 2 N 2 RUMUS INI HANYA BERLAKU SAMPAI KULIT NOMOR 4 No Kulit n=1 N=2 N=3 N=4 N=5 N=6 N=7 Macam sub kulit S S,p S,p,d S,p,d,f S,p,d,f S,p,d S,p Jumlah orbital Elektron maksimum 1 4 9 16 16 9 4 2 8 18 32 32 18 8
- 13. Elektron valensi Merupakan jumlah elektron pada kulit terluar yang menunjukkan golongannya ( untuk golongan utama). Elektron valensi sangat menentukan sifat-sifat kimia suatu unsur. Contoh : 20 Ca 20 Ca : 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 atau [ 18 Ar ] 4S 2 Kulit terluar n = 4, pada orbital s ada 2 elektron, jadi lektron valensi Ca = 2 Berapa elektron valensi : a. 35 Br b. 13 Al c. 37 Rb
- 14. TERIMA KASIH
































