Sel volta
- 2. Oleh : Mita Putri Indrayanti (20) Realita Ismaning Rahayu (28) Kelas XII IPA 1 SMA Negeri 1 Purbalingga
- 3. SEL VOLTA
- 4. A. Sel Volta Primer B. Sel Volta Sekunder Sel Kering Sel Mercury Sel Alkalin Sel Lithium Ionida Sel Aki Sel Nikel Kadmium
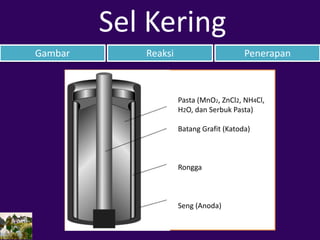
- 5. Pasta (MnO2, ZnCl2, NH4Cl, H2O, dan Serbuk Pasta) Batang Grafit (Katoda) Rongga Seng (Anoda) Gambar Reaksi Penerapan Sel Kering
- 6. Gambar Reaksi Penerapan Sel Kering Anode : Zn(s) → Zn2+(aq) + 2 e– Katode : 2 MnO2(s) + 2 NH4 +(aq) + 2 e– → Mn2O3(s) + 2 NH3(g) + H2O(l) Zn(s) + 2 MnO2(s) + 2 NH4+(aq)→Mn2O3(s) + Zn2+(aq) + 2 NH3(g) + H2O(l)
- 7. Gambar Reaksi Penjelasan Sel Kering Sel kering atau yang sering disebut dengan sel seng karbon atau Leclanche menggunakan seng sebagai anodanya dan batang grafit sebagai katodanya. Satu baterai ini memiliki potensial 1,5 Volt. Kelemahannya yaitu mudah habis (bila sering digunakan dan bila terkena suhu rendah) dan tidak dapat diisi ulang. Kelebihannya yaitu praktis, ukurannya kecil, harganya ekonomis, dan aman digunakan.
- 8. Gambar Reaksi Penjelasan Sel Alkalin Pasta (MnO2, ZnCl2, KOH, H2O, dan Serbuk Pasta) Batang Grafit (Katoda) Rongga Seng (Anoda)
- 9. Gambar Reaksi Penjelasan Sel Alkalin Anode : Zn(s) + 2 OH–(aq) → Zn(OH)2(s) + 2 e– Katode : 2 MnO2(s) + 2 H2O(l) + 2 e– → 2 MnO(OH)(s) + 2 OH–(aq) 2 MnO2(s) + 2 H2O(l) + Zn(s) → 2 MnO(OH)(s) + Zn(OH)2(s)
- 10. Gambar Reaksi Penjelasan Sel Alkalin Pada umumnya , prinsip dari Sel Alkalin sama dengan sel kering. Hanya saja, pada sel alkalin suasananya basa karena NH4Cl diganti dengan KOH. Potensialnya juga sama dengan sel kering, yaitu 1,5 Volt. Sel Alkalin lebih awet (tidak mudah habis) dan tidak dapat diisi ulang.
- 11. Reaksi Penjelasan Sel Mercury Anode: Zn + 2OH- → ZnO + H2O+ 2e- Katode: HgO + H2O+2e- → Hg+2OH- Zn + HgO → ZnO + Hg
- 12. Reaksi Penjelasan Sel Mercury Sel mercury atau baterai Mercury biasa digunakan untuk baterai arloji, kalkulator, alat-alat kesehatan, dan lain-lain. Saat ini, baterai Mercury mulai ditarik dari peredaran karena dianggap berbahaya. Baterai mercury ini mengandung logam-logam berat yang berbahaya bagi manusia. Potensial seng Mercury sebesar 1,35 Volt. Diantara seng (Anoda) dan Mercury (Katoda), terdapat zat elektrolit kalium hidroksida (KOH)
- 13. Reaksi Penjelasan Sel Lithium Ionida Anode: 2Li → 2Li+ + 2e- Katode: 3I2+2e- → 2I3 - 2Li + 3I2 → 2Li+ + 2I3 -
- 14. Reaksi Penjelasan Sel Lithium Ionida Sel Lithium Ionida memilik potensial 3,6 Volt. Sel ini dapat diisi ulang. Contohnya yaitu baterai HP dan baterai mainan. Sel ini menggunakan Lithium sebagai anodanya dan senyawa kompleks I2 sebagai katodanya. Diantara anoda dan katoda terdapat zat elektrolit yaitu lapisan tipis dari lithium ionida.
- 15. Reaksi Penjelasan Sel Nikel Kadmium Anoda : Cd+2OH- → Cd(OH)2 +2e- Katoda : 2NiO(OH)+2H2O+2e- → 2NiO(OH)2+2OH- Cd+2NiO(OH)+2H2O → Cd(OH)2+2NiO(OH)2
- 16. Reaksi Penjelasan Sel Nikel Kadmium Beberapa peralatan di sekitar kita menggunakan baterai sel nikel kadmium. Contohnya beberapa jenis HP dan lampu penerang. Baterai nikel kadmium memiliki potensial 1,2 Volt. Menggunakan kalium hidroksida sebagai elektrolitnya. Dapat diisi ulang.
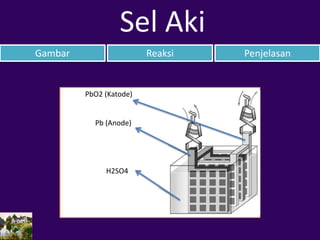
- 17. PbO2 (Katode) Pb (Anode) H2SO4 Gambar Reaksi Penjelasan Sel Aki
- 18. Gambar Reaksi Penjelasan Sel Aki Anode : Pb(s) + SO4 2–(aq) → PbSO4(s) + 2 e– Katode: PbO2(s) + H2SO4(aq) + 2 H+ + 2 e– → PbSO4(s) + 2H2O(l) Reaksi: Pb(s) + PbO2(s) + 2 H2SO4 → 2 PbSO4(s) + 2 H2O
- 19. Gambar Reaksi Penjelasan Sel Aki Sel aki (Accumulator) merupakan contoh sel Volta sekunder. Sel aki terdiri atas elektrode Pb (anode) dan PbO2 (katode). Keduanya dicelupkan dalam larutan H2SO4 30%.
- 20. KOROSI Cara Mencegah Korosi AlPengertian Korosi Besi Kerugian
- 21. Korosi adalah kerusakan atau degradasi logam akibat reaksi redoks antara suatu logam dengan berbagai zat di lingkungannya yang menghasilkan senyawa-senyawa yang tidak dikehendaki. Dalam bahasa sehari-hari, korosi disebut perkaratan. Cara Mencegah Korosi AlPengertian Korosi Besi Kerugian
- 22. Pada peristiwa korosi, logam mengalami OKSIDASI, sedangkan oksigen (udara) mengalami REDUKSI. Karat logam umumnya adalah berupa oksida atau karbonat. Rumus kimia karat besi adalah Fe2O3.nH2O, suatu zat padat yang berwarna coklat- merah. Korosi merupakan proses ELEKTROKIMIA. Pada korosi besi, bagian tertentu dari besi itu berlaku sebagai ANODE, di mana besi mengalami oksidasi. FE(S) <--> FE2+(AQ) + 2E Elektron yang dibebaskan di anode mengalir ke bagian lain dari besi itu yang bertindak sebagai katode, di mana oksigen tereduksi. O2(G) + 4H+(AQ) + 4E <--> 2H2O(L) atau O2(g) + 2H2O(l) + 4e <--> 4OH-(aq) Ion besi(II) yang terbentuk pada anode selanjutnya teroksidasi membentuk ion besi(III) yang kemudian membentuk senyawa oksida terhidrasi, yaitu karat besi. Mengenai bagian mana dari besi itu yang bertindak sebagai anode dan bagian mana yang bertindak sebagai katode, bergantung pada berbagai faktor, misalnya zat pengotor, atau perbedaan rapatan logam itu. Cara Mencegah Korosi AlPengertian Korosi Besi Kerugian
- 23. • Dicat, cat menghindarkan kontak besi dengan udara dan air. • Melumuri dengan oli atau minyak. • Dibalut dengan plastik . • Tin plating (pelapisan dengan timah), biasanya kaleng-kaleng kemasan terbuat dari besi dilapisi dengan timah. Pelapisan dilakukan secara elektrolisis, yang disebut electro plating. Timah tergolong logam yang tahan karat. Akan tetapi, lapisan timah hanya melindungi besi selama lapisan utuh (tanpa cacat). • Galvanisasi (pelapisan dengan zink). Berbeda dengan timah, zink dapat melindungi besi dari korosi sekalipun lapisannya tidak utuh. • Cromium plating (pelapisan dengan kromium), besi atau baja juga dapat dilapisi dengan kromium untuk memberi lapisan pelindung yang mengkilap. • Sacrificial protection (pengorbanan anode), magnesium adalah logam yang jauh labih aktif (berarti lebih mudah berkarat) daripada besi. Jika logam magnesium dikontakkan dengan besi maka magnesium itu akan berkarat tetapi besi tidak. Cara ini digunakan untuk melindungi pipa baja yang ditanam dalam tanah atau badan kapal laut. Secara periodik, batang magnesium harus diganti. Cara Mencegah Korosi AlPengertian Korosi Besi Kerugian
- 24. Aluminium, juga zink dan kromium, merupakan logam yang lebih aktif daripada besi. jika demikian, mengapa logam-logam ini lebih awet? sebenarnya, aluminium berkarat dengan cepat membentuk oksida aluminium (al2o3). akan tetapi, perkaratan segera terhenti setelah lapisan tipis oksida terbentuk. lapisan itu melekat pada permukaan logam, sehingga melindungi logam di bawahnya terhadap perkaratan berlanjut. Lapisan oksida pada permukaan aluminium dapat dibuat lebih tebal melalui elektrolisi, yang disebut anodizing. aluminium yang telah mengalami anodizing digunakan untuk membuat panci dan berbagai perkakas dapur, bingkai, kerangka bangunan (panel dinding), serta kusen pintu dan jendela. lapisan oksida aluminium lebih mudah dicat dan memberi warna yang lebih terang. Cara Mencegah Korosi AlPengertian Korosi Besi Kerugian
- 25. 1. Adanya kerugian teknis dan depresiasi 2. menurunnya efisiensi 3. menurunnya kekuatan konstruksi seperti keropos, berlubang. 4. Perubahan warna atau penampilan 5.karat merupakan polusi dan menambah biaya maintenance 6.Terkontaminasinya suatu produk 7.Berkurangnya faktor keamanan. selain menimbulkan kerugian korosi juga menguntungkan diantaranya adalah adanya pabrik cat (coating), adanya pekerjaan cathodic protection Cara Mencegah Korosi AlPengertian Korosi Besi Kerugian