Kovalentna veza
- 3. Udruživanjem elektrona dva atoma istih ili različitih nemetala u jedan ili više zajedničkih elektronskih parova 
- 4.  Nastaje građenjem zajedničkih elektronskih parova između istih atoma nemetala.  Nepolarna je jer ne postoji razlika u elektronegativnosti između atoma, tako da se zajednički elektronski par ili parovi nalaze tačno na sredini, između atoma, odnosno naelektrisanje je podjednako raspoređeno oko oba atoma.
- 6. Atomima vodonika nedostaje po 1elektron da bi postigli stabilnu elektronsku konfiguraciju. Udruživanjem 2 atoma H, odnosno po JEDNOG valentnog elektrona svakog od njih, nastaje JEDAN zajednički elektronski par, odnosno molekul elementa vodonika u kome su atomi povezani JEDNOSTRUKOM KOVALENTNOM VEZOM 
- 8.  Atomima kiseonika nedostaju po 2 elektrona da bi postigli stabilnu elektronsku konfiguraciju.  Udruživanjem 2 atoma O, odnosno po DVA valentna elektrona svakog od njih, nastaju DVA zajednička elektronska para, odnosno molekul elementa kiseonika u kome su atomi povezani DVOSTRUKOM KOVALENTNOM VEZOM
- 10. Atomima azota nedostaju po 3 elektrona da bi postigli stabilnu elektronsku konfiguraciju. Udruživanjem 2 atoma N, odnosno po TRI valentna elektrona svakog od njih, nastaju TRI zajednička elektronska para, odnosno molekul elementa azota u kome su atomi povezani TROSTRUKOM KOVALENTNOM VEZOM 
- 11.   U molekulu elementa hlora nagrađena je jednostruka nepolarna kovalentna veza U molekulu jedinjenja metana nagrađene su 4 jednostruke, slabopolarne kovalentne veze
- 12. Nastaje građenjem zajedničkih elektronskih parova između različitih atoma nemetala.  Polarna je jer postoji razlika u elektronegativnosti između atoma, tako da se zajednički elektronski par ili parovi ne nalaze tačno na sredini između atoma, odnosno naelektrisanje je nejednako raspoređeno elektroni su bliži atomu koji ima veću elektronegativnost. 
- 13.   U molekulu amonijaka – NH3 nagrađene su 3 polarne, jednostruke kovalentne veze. U molekulu ugljen–dioksida – CO2 nagrađene su 2 dvostruke, polarne kovalentne veze
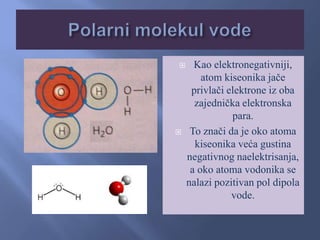
- 14. U molekulima jedinjenja (voda, hlorovodonik, amonijak..), postoje dva električna pola – pozitivni i negativni. Takvi molekuli nazivaju se DIPOLI.  U okolini atoma koji ima veću elektronegativnost veća je i gustina elektronskog oblaka (elektroni su mu bliži), pa je na tom kraju molekula delimično negativno naelektrisanje - δ−. Na suprotnom kraju molekula, bliže atomu koji ima manju elektronegativnost, postoji delimično pozitivno naelektrisanje - δ+ 
- 15.   Kao elektronegativniji, atom kiseonika jače privlači elektrone iz oba zajednička elektronska para. To znači da je oko atoma kiseonika veća gustina negativnog naelektrisanja, a oko atoma vodonika se nalazi pozitivan pol dipola vode.