Models atoﮊmics 2017
- 1. Models atﺣﺎmics Quﺣmica 2n Batxillerat - IES SantVicent Ferrer - Algemesﺣ
- 2. Lﻗﺣ tom ﺣ۸s divisible: fenﺣﺎmens que ho suggereixen ﺅ La conductivitat elﺣ۷ctrica de les dissolucions i la teoria de la dissociaciﺣﺏ iﺣﺎnica ﺅ Les experiﺣ۷ncies en tubs de gasos incandescents (raigs catﺣﺎdics i anﺣﺎdics) i el descobriment de lﻗelectrﺣﺏ, la primera partﺣcula subatﺣﺎmica, i del protﺣﺏ ﺅ Lﻗestudi de la radioactivitat: els raigs ﺳﺎ, ﺳﺎ i ﺳﺏ ﺅ Els models deThomson i Rutherford ﺅ Lﻗexperiﺣ۷ncia de Rutherford
- 3. Els orﺣgens de lﻗelectroﺎﻝﺏﻎﺣﺏﺝﺝﺎﺏ۵ﺎﺗ ﺅ A principis del segle XIX, Davy i Faraday investigaren la conductivitat elﺣ۷ctrica de certes dissolucions anomenades ELECTRﺣLITS, on la conducciﺣﺏ elﺣ۷ctrica anava acompanyada dﻗuna reacciﺣﺏ dﻗELECTRODESCOMPOSICIﺣ o ELECTRﺣLISI ﺅ Per a explicar-ho postularen lﻗexistﺣ۷ncia dﻗﺣ toms amb cﺣ rrega elﺣ۷ctrica, els anomenats: IONS. Nﻗhi havia de dos tipus: ANIONS (-) i CATIONS (+). Foren els inicis de la teoria iﺣﺎnica ﺅ La teoria de la DISSOCIACIﺣ IﺣNICA de Svante Arrhenius ampliﺣ aquestes hipﺣﺎtesis explicant que les substﺣ ncies iﺣﺎniques en dissoldre-les es separaven en ions positius i ions negatius, portadors de cﺣ rrega neta ﺅ Si els ﺣTOMS poden ser portadors de cﺣ rrega neta i discreta, haurien dﻗestar constituﺣﺁts per partﺣcules mﺣ۸s petites portadores de cﺣ rrega que es puguen intercanviar, perﺣﺎ com seria aixﺣﺎ possible si els ﺣTOMS QUﺣMICS sﺣﺏn INDIVISIBLES!!!
- 5. Svante Arrhenius (1859-1927) Autor de la teoria de la dissociaciﺣﺏ iﺣﺎnica Quﺣ۷ queda de lﻗﺣTOM INDIVISIBLE i IMMUTABLE de laTEORIA ATﺣMICA de John DALTON? John Dalton (1766-1844)
- 6. Descﺣ rregues en tubs de gasos ﺅ Els raigs catﺣﺎdics: tenen cﺣ rrega elﺣ۷ctrica negativa (es desvien en presﺣ۷ncia dﻗun imant), interaccionen amb objectes sﺣﺎlids (tenen massa), fan ombres nﺣtides (es propaguen en lﺣnia recta), semblen procedir del cﺣ tode (-)
- 7. Els raigs catﺣﺎdics fan ombres en els obstacles, perquﺣ۷ es propaguen en lﺣnia recta
- 8. El descobriment de lﻗelectrﺣﺏ ﺅ Els experiments de J.J.Thomson (1897) demostraren que els raigs catﺣﺎdics estaven formats per partﺣcules de cﺣ rrega negativa que sﻗanomenaren electrons. Els resultats donaren una relaciﺣﺏ q/m = 1,76ﺡﺓ1011 C/kg, independentment de la naturalesa del gas
- 9. La cﺣ rrega de lﻗelectrﺣﺏ ﺅ Lﻗexperiment de les gotes dﻗoli, fet per Robert Millikan (1909), donﺣ com a resultat una cﺣ rrega bﺣ sica que correspondria a la cﺣ rrega dels electrons. En unitats del S.I. resulta ser: qe = -1,6ﺡﺓ10-19 C
- 10. Quina ﺣ۸s la massa dﻗun electrﺣﺏ? ﺅ Dels experiments deThomson coneixem la relaciﺣﺏ q/m ﺅ Dels experiments de Millikan coneixem qe ﺅ Per tant: q/m = 1,76ﺡﺓ1011 C/kg qe = 1,6ﺡﺓ10-19 C aﺣﺁllem m = 1,6ﺡﺓ10-19 / 1,76ﺡﺓ1011 kg = 9,09ﺡﺓ10-31 kg ﺅ Perﺣﺎ quﺣ۷ significa el resultat obtingut? ﺅ Si el comparem amb la massa atﺣﺎmica de lﻗhidrogen tenim:
- 11. Massa de lﻗelectrﺣﺏ en unitats de massa atﺣﺎmica relativa ﺅ Ar(H) = 1 perﺣﺎ si lﻗexpressem en kg obtindrem un valor a comparar amb la massa de lﻗelectrﺣﺏ abans calculada ﺅ Com sabem que la massa molar de lﻗhidrogen ﺣ۸s 1 g/mol dﻗﺣ toms dﻗH, i en 1 mol hi ha aproximadament 6,022ﺡﺓ1023 ﺣ toms tindrem: 6,022ﺡﺓ1023 ﺣ toms pesen 1 g = 10-3 kg 1 ﺣ tom pesarﺣ : 10-3 / 6,022ﺡﺓ1023 = 1,66ﺡﺓ10-27 kg ﺅ Si ho comparem amb lﻗelectrﺣﺏ, veurem que la massa dﻗaquest ﺣ۸s MOLT INFERIOR a la de lﻗﺣ tom mﺣ۸s lleuger. Si dividim el major pel menor obtenim: mH/me = 1827 o bﺣ۸ me/mH = 0,00055
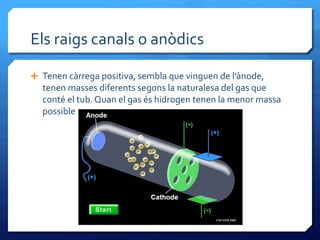
- 12. Els raigs canals o anﺣﺎdics ﺅ Tenen cﺣ rrega positiva, sembla que vinguen de lﻗﺣ node, tenen masses diferents segons la naturalesa del gas que contﺣ۸ el tub. Quan el gas ﺣ۸s hidrogen tenen la menor massa possible
- 13. El descobriment del protﺣﺏ ﺅ Els experiments de Goldstein (1886) en tubs de raigs anﺣﺎdics mostraren lﻗexistﺣ۷ncia dﻗuna partﺣcula molt simple de cﺣ rrega positiva i dﻗuna massa semblant a lﻗhidrogen, que anomenaren protﺣﺏ. ﺅ La massa dﻗun protﺣﺏ ﺣ۸s 1836 vegades major que la dﻗun electrﺣﺏ i el protﺣﺏ ﺣ۸s neutralitza quan capta un electrﺣﺏ. Quina ﺣ۸s la massa i la cﺣ rrega dﻗun protﺣﺏ? Si la massa dﻗun electrﺣﺏ val me = 9,09ﺡﺓ10-31 kg i la massa dﻗun protﺣﺏ ﺣ۸s 1836 vegades major, aixﺣﺎ vol dir que mp = 1836 ﺡﺓ 9,09ﺡﺓ10-31 = 1,67ﺡﺓ10-27 kg (a quﺣ۷ sﻗassembla?) Si el protﺣﺏ es neutralitza quan captura un electrﺣﺏ vol dir que tenen la mateixa cﺣ rrega perﺣﺎ de signe contrari: qe = -1,6ﺡﺓ10-19C ; qp = +1,6ﺡﺓ10-19C
- 14. Animacions a laWEB ﺅ Raigs catﺣﺎdics http://www.youtube.com/watch?v=4QAzu6fe8rE ﺅ Lﻗexperiment de Millikan http://www.youtube.com/watch?v=XMfYHag7Liw http://www.youtube.com/watch?v=62CDDZo9t48&feature=related ﺅ Radioactivitat http://www.youtube.com/watch?v=vuGvQjCOdr0 http://www.youtube.com/watch?NR=1&v=ec8iomUS34U ﺅ Lﻗexperiment de Rutherford http://www.youtube.com/watch?v=kHaR2rsFNhg&feature=related
- 15. Quﺣ۷ ﺣ۸s la radioactivitat? ﺅ Les investigacions dels esposos Curie, Marie i Pierre, obriren el camﺣ a explicar els estranys fenﺣﺎmens observats per Henri Becquerel en el comportament de les sals dﻗurani sobre unes plaques fotogrﺣ fiques
- 16. ﺅ Arribaren a la conclusiﺣﺏ que, no sols les sals dﻗurani, sinﺣﺏ tambﺣ۸ les de nous elements que aﺣﺁllaren i caracteritzaren, com el poloni i el radi, tots ells elements de massa atﺣﺎmica molt gran, tenien la propietat dﻗirradiar al seu voltant de forma totalment espontﺣ nia el que ells van anomenar RADIOACTIVITAT o emissions radioactives
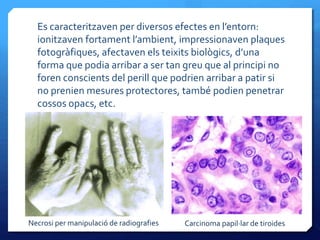
- 17. Es caracteritzaven per diversos efectes en lﻗentorn: ionitzaven fortament lﻗambient, impressionaven plaques fotogrﺣ fiques, afectaven els teixits biolﺣﺎgics, dﻗuna forma que podia arribar a ser tan greu que al principi no foren conscients del perill que podrien arribar a patir si no prenien mesures protectores, tambﺣ۸ podien penetrar cossos opacs, etc. Carcinoma papilﺡﺓlar de tiroidesNecrosi per manipulaciﺣﺏ de radiografies
- 18. Tipus de radiacions ﺅ Ernest Rutherford ampliﺣ les investigacions dels esposos Curie i amb la seua colﺡﺓlaboraciﺣﺏ van caracteritzar les emissions radioactives on trobaren fins aTRES tipus diferents de radiacions, anomenades: ﺳﺎ, ﺳﺎ i ﺳﺏ ﺅ Raigs ﺳﺎ : tenen CﺣRREGA POSITIVA (+2), massa atﺣﺎmica Ar = 4, travessen lﻗaire, perﺣﺎ no un full de paper ﺅ Raigs ﺳﺎ : tenen CﺣRREGA NEGATIVA (-1), massa atﺣﺎmica com els electrons, travessen el paper perﺣﺎ no una lﺣ mina dﻗAl ﺅ Raigs ﺳﺏ : no tenen ni cﺣ rrega (0), ni massa (0), sﺣﺏn com raigs X de molt alta energia i nomﺣ۸s sﺣﺏn absorbits per una lﺣ mina de Pb
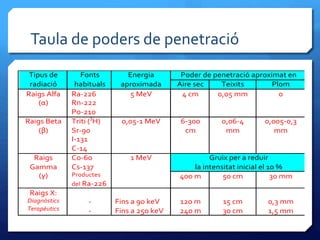
- 19. Taula de poders de penetraciﺣﺏ Tipus de radiaciﺣﺏ Fonts habituals Energia aproximada Poder de penetraciﺣﺏ aproximat en Aire sec Teixits Plom Raigs Alfa (ﺳﺎ) Ra-226 Rn-222 Po-210 5 MeV 4 cm 0,05 mm 0 Raigs Beta (ﺳﺎ) Triti (3 H) Sr-90 I-131 C-14 0,05-1 MeV 6-300 cm 0,06-4 mm 0,005-0,3 mm Raigs Gamma (ﺳﺏ) Co-60 Cs-137 Productes del Ra-226 1 MeV Gruix per a reduir la intensitat inicial el 10 % 400 m 50 cm 30 mm Raigs X: Diagnﺣﺎstics Terapﺣ۷utics - - Fins a 90 keV Fins a 250 keV 120 m 240 m 15 cm 30 cm 0,3 mm 1,5 mm
- 20. El model atﺣﺎmic deThomson ﺅ Els experiments amb els tubs de raigs catﺣﺎdics dugueren a la convicciﺣﺏ que lﻗﺣ tom devia tenir una estructura interna per a poder explicar la formaciﺣﺏ dﻗaquest fenomen ﺅ J.J.Thomson suposﺣ que la major part de lﻗﺣ tom estaria constituﺣﺁda per la cﺣ rrega positiva, necessﺣ ria per a equilibrar la cﺣ rrega negativa dels electrons que sﻗalliberen en els raigs catﺣﺎdics ﺅ Si el gruix de lﻗﺣ tom el constituﺣﺁa una zona massiva de cﺣ rrega positiva, la cﺣ rrega negativa sﻗhauria de moure per tot lﻗﺣ tom inserida en la massa positiva, dﻗaixﺣﺎ seﻗn diu MODEL ATﺣMIC DETHOMSON
- 21. Joseph JohnThomson (1856-1940) Model estﺣ tic deThomson Model dinﺣ mic de Kelvin -Thomson PRIMERS MODELSATﺣMICS
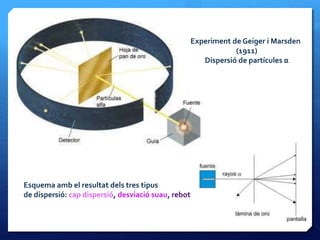
- 22. Lﻗexperiment de Rutherford ﺅ Per tal de verificar el model deThomson, Ernest Rutherford dissenyﺣ un experiment fonamental, on bombardejava fines lﺣ mines dﻗor i dﻗaltres metalls amb partﺣcules radioactives (ﺳﺎ) ﺅ Les seues prediccions suposaven que la majoria de les partﺣcules havien de dispersar-se de forma mﺣ۸s o menys homogﺣ۷nia, atﺣ۷s que lﻗﺣ tom, segonsThomson, era massﺣs ﺅ Els resultats de lﻗexperiment foren totalment inesperats: les partﺣcules travessaven quasi per complet les lﺣ mines, sense desviar-se gens, algunes es desviaven uns pocs graus i, de tant en tant, algunes rebotaven en grans angles
- 23. Experiment de Geiger i Marsden (1911) Dispersiﺣﺏ de partﺣcules ﺳﺎ Esquema amb el resultat dels tres tipus de dispersiﺣﺏ: cap dispersiﺣﺏ, desviaciﺣﺏ suau, rebot
- 24. DETALLSTﺣCNICS DE LﻗEXPERIMENT: Substﺣ ncia radioactiva: el RADI, recentment obtingut pels esposos Curie, emet partﺣcules ﺳﺎ a uns 107 m/s, de forma uniforme (bloc de Pb) Blanc on incidir: metall molt malﺡﺓleable, lﺣ mines fines. Sﻗemprﺣ lﻗOR dﻗon es poden obtenir lﺣ mines dﻗespessor 0,1 ﺳﺙm Sistema detector: pantalla mﺣﺎbil de ZnS que produeix luminescﺣ۷ncia
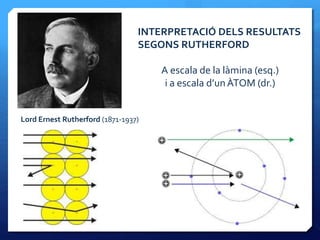
- 25. Lord Ernest Rutherford (1871-1937) INTERPRETACIﺣ DELS RESULTATS SEGONS RUTHERFORD A escala de la lﺣ mina (esq.) i a escala dﻗunﺣTOM (dr.)
- 26. El model atﺣﺎmic de Rutherford ﺅ Els sorprenents resultats de lﻗexperiment de dispersiﺣﺏ de partﺣcules ﺳﺎ suggeriren a Lord Rutherford i els seus ajudants Geiger i Marsden, la possibilitat que lﻗﺣ tom no fora massﺣs sinﺣﺏ ben al contrari estiguera buit en la seua major part i quasi tota la massa es concentrara en una part central anomenada NUCLI ATﺣMIC ﺅ Un primer cﺣ lcul que feren fou la RELACIﺣ ENTRE EL RADI ATﺣMIC I EL RADI NUCLEAR: rat/rnuc ﻗ 10 000 ﺅ Determinaren la CﺣRREGA NUCLEAR (+), que sempre era mﺣﭦltiple enter de la cﺣ rrega dﻗun electrﺣﺏ, perﺣﺎ positiva. Per aixﺣﺎ pensaren que el nucli estaria format per Z protons
- 27. Lﻗﺣ tom nuclear de Rutherford ﺅ Amb aixﺣﺎ quedava una dada per explicar, la massa atﺣﺎmica no corresponia al total de protons i electrons ﺅ Ells postularen lﻗexistﺣ۷ncia al nucli dﻗuna tercera partﺣcula, sense cﺣ rrega i amb una massa semblant a la del protﺣﺏ, que anomenaren NEUTRﺣ. No es confirmaria la seua existﺣ۷ncia fins lﻗany 1932 que James Chadwick el descobrﺣ ﺅ Segons aixﺣﺎ el nucli estaria format per Z protons (nombre atﺣﺎmic) i N neutrons, que sumats donarien: A = Z + N, on A ﺣ۸s el nombre mﺣ ssic, nombre enter prﺣﺎxim al valor de la massa atﺣﺎmica, perﺣﺎ DIFERENT
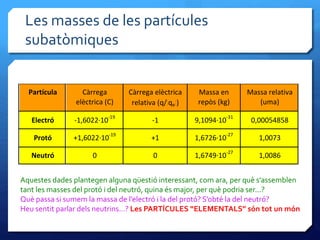
- 28. Les masses de les partﺣcules subatﺣﺎmiques Partﺣcula Cﺣ rrega elﺣ۷ctrica (C) Cﺣ rrega elﺣ۷ctrica relativa (q/|qe|) Massa en repﺣﺎs (kg) Massa relativa (uma) Electrﺣﺏ -1,6022ﺡﺓ10 -19 -1 9,1094ﺡﺓ10 -31 0,00054858 Protﺣﺏ +1,6022ﺡﺓ10 -19 +1 1,6726ﺡﺓ10 -27 1,0073 Neutrﺣﺏ 0 0 1,6749ﺡﺓ10 -27 1,0086 Aquestes dades plantegen alguna qﺣﺙestiﺣﺏ interessant, com ara, per quﺣ۷ sﻗassemblen tant les masses del protﺣﺏ i del neutrﺣﺏ, quina ﺣ۸s major, per quﺣ۷ podria ser...? Quﺣ۷ passa si sumem la massa de lﻗelectrﺣﺏ i la del protﺣﺏ? Sﻗobtﺣ۸ la del neutrﺣﺏ? Heu sentit parlar dels neutrins...? Les PARTﺣCULES ﻗELEMENTALSﻗ sﺣﺏn tot un mﺣﺏn
- 29. Limitacions del model de Rutherford ﺅ Aconseguﺣ explicar: formaciﺣﺏ dﻗanions i cations, identificar el nucli dels ﺣ toms on es concentra la seua massa, definir els elements a partir de Z i predir lﻗexistﺣ۷ncia dels neutrons ﺅ Limitaciﺣﺏ: INESTABILITATTEﺣRICA (segons les lleis de lﻗelectromagnetisme un electrﺣﺏ amb un moviment accelerat va perdent energia i sﻗestavellaria contra el nucli) ﺅ Limitaciﺣﺏ: DIFICULTAT PER A EXPLICAR ELS ESPECTRES ATﺣMICS (els espectres atﺣﺎmics sﺣﺏn discontinus, ﺣ۸s a dir tenen ratlles). Si lﻗelectrﺣﺏ perdera energia contﺣnuament els espectres atﺣﺎmics serien continus (lﻗarc iris, p.e.)
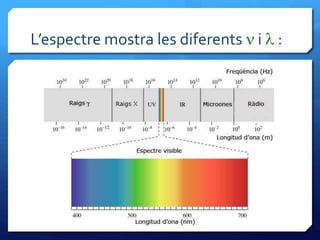
- 30. Quﺣ۷ sﺣﺏn els espectres atﺣﺎmics? ﺅ Quan lﻗenergia lluminosa interacciona amb la matﺣ۷ria sﻗaltera la composiciﺣﺏ dels ﺣ toms, els seus electrons canvien dﻗestat ﺅ Si sotmetem un gas a baixa pressiﺣﺏ a un voltatge molt elevat podem aconseguir que esdevinga INCANDESCENT ﺅ La matﺣ۷ria incandescent EMET LLUMVISIBLE i tambﺣ۸ radiaciﺣﺏ no visible (IR, UV...) perﺣﺎ detectable amb aparells ﺅ Si fem passar la llum emesa per un PRISMA DEVIDRE o UNA XARXA DE DIFRACCIﺣ, es produeix el fenomen de la DISPERSIﺣ o DESCOMPOSICIﺣ DE LA LLUM EN COLORS o mﺣ۸s exactament en FREQﺣﺣNCIES DIFERENTS
- 31. Lﻗespectre mostra les diferents n i l :
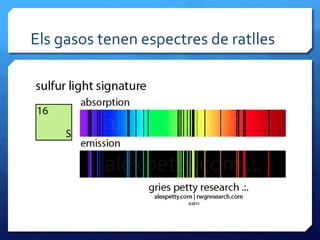
- 32. Els gasos tenen espectres de ratlles
- 33. Niels Bohr proposa un model per explicar els espectres atﺣﺎmics i lﻗestabilitat atﺣﺎmica ﺅ Niels Bohr va tindre en compte una IDEA NOVA en fﺣsica, proposada per Max Plank: QUAN INTERACCIONEN MATﺣRIA I ENERGIA ELS INTERCANVIS ES PRODUEIXEN EN FORMA DE PAQUETS MﺣNIMS DﻗENERGIA. Un paquet dﻗenergia sﻗanomena QUANTUM i val: E = hﺡﺓn ﺅ Aixﺣ va formular diferents principis en forma de POSTULATS per explicar quﺣ۷ passa en un ﺣ tom senzill com lﻗHIDROGEN ﺅ Segons BOHR lﻗﺣﭦnic electrﺣﺏ de lﻗhidrogen pega voltes al nucli (protﺣﺏ) en ﺣﺎrbites estables i pot canviar dﻗuna ﺣﺎrbita a una altra quan intercanvia energia
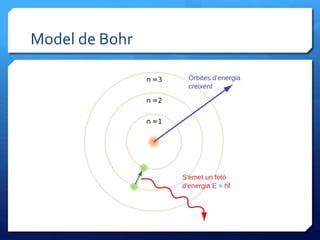
- 34. ﺣrbites permeses i prohibides ﺅ Quan lﻗelectrﺣﺏ rep energia i per tantCREIX la seua energia, bota dﻗuna ﺣﺎrbita interior a una mﺣ۸s externa ﺅ Quan un electrﺣﺏ perd energia i per tant DISMINUEIX la seua energia, bota de fora cap a dins ﺅ En ambdﺣﺏs casos la diferﺣ۷ncia dﻗenergia entre ﺣﺎrbites es transforma en LLUM DE CERTA FREQﺣﺣNCIA segons la fﺣﺏrmula de Planck: DE = hﺡﺓn ﺅ Nomﺣ۸s hi ha un problema: LﻗELECTRﺣ NO POT ESTAR EN QUALSEVOL ﺣRBITA, PERQUﺣ HI HA ﺣRBITES PROHIBIDES I ﺣRBITES PERMESES
- 35. Model de Bohr
- 36. Lﻗespectre dﻗhidrogen segons Bohr LﻗHIDROGEN ﺣS LﻗﺣTOM MﺣS SENZILL PER AIXﺣ EL SEU ESPECTRE TAMBﺣ ﺣS SENZILL. EN LA ZONAVISIBLE LﻗESPECTRE DﻗEMISSIﺣ Tﺣ QUATRE RATLLES PRINCIPALS: ROJA, BLAVA,VIOLETA IVIOLETA. LES RATLLES CORRESPONEN ATRANSICIONS ENTRE ﺣRBITES. P. E., LA DE COLOR ROIG CORRESPON AL SALT DE LﻗELECTRﺣ ENTRE LES ﺣRBITESTERCERA I SEGONA I ELS ALTRES COLORS CORRESPONEN A SALTS DES DﻗﺣRBITES MﺣS LLUNYANES SEMPRE ACABANT EN LA SEGONA ﺣRBITA
- 37. Limitacions del model de Bohr ﺅ Lﻗﺣﭦnic espectre que explica ﺣ۸s el dﻗHIDROGEN ﺅ La resta dﻗespectres atﺣﺎmics sﺣﺏn massa complexos ﺅ Quan milloren les tﺣ۷cniques dﻗanﺣ lisi es comprova que el mateix espectre dﻗhidrogen tﺣ۸ aspectes inexplicables: TOTES LES RATLLES NO BRILLEN AMB LA MATEIXA INTENSITAT i, a mﺣ۸s, NﻗHI HA DE MﺣS NﺣTIDES I DE MﺣS DIFUSES ﺅ Si, a mﺣ۸s, utilitzem camps magnﺣ۷tics que interferisquen amb lﻗhidrogen incandescent, ALGUNES RATLLES ES DESDOBLEN EN MULTIPLETS ﺅ EL MODEL DE BOHR ﺣS UNA PRIMERA APROXIMACIﺣ PERﺣ NO ﺣS ENCARA UN MODEL SUFICIENTMENT EXACTE
- 38. CAP AL MODEL QUﺣNTIC DE LﻗﺣTOM ﺅ Desprﺣ۸s de Bohr els cientﺣfics preferiren comenﺣ۶ar-ho tot de nou, reescrivint les lleis de la Fﺣsica en una nova ciﺣ۷ncia que coneixem com a FﺣSICA QUﺣNTICA