1 of 5
Downloaded 20 times




Recommended
Mètode de l'ió-electró



Mètode de l'ió-electróFernando Recreo
Őż
Ajustament d'equacions redox pel mètode de l'ió-electró.Osmosi d'una patata.



Osmosi d'una patata.adaura
Őż
Experiment per demostrar el proc√©s osm√≤tic en les c√®l.lules de la patata.Biologia 2n Batxillerat. U03. Els gl√ļcids



Biologia 2n Batxillerat. U03. Els gl√ļcidsOriol Baradad
Őż
Presentació del tema 3 de l'assignatura de biologia de 2n de batxillerat.
Presentaci√≥ preparada amb el llibre de 2n de Batxillerat Santillana i altres materials.UD2 L'AIGUA, LA MOL√ąCULA DE LA VIDA



UD2 L'AIGUA, LA MOL√ąCULA DE LA VIDAM√≠riam Redondo D√≠az (Naturalsom)
Őż
UD2 BIOMOL√ąCULES
Biologia. 1r Batxillerat38. les membranes de secreció



38. les membranes de secrecióDani Ribo
Őż
Primer de batxillerat, biologia.
Les membranes de secrecióBiologia 2n Batxillerat. U06. Els àcids nucleics



Biologia 2n Batxillerat. U06. Els àcids nucleicsOriol Baradad
Őż
Presentació del tema 6 de l'assignatura de biologia de 2n de batxillerat.
Presentació preparada amb el llibre de 2n de Batxillerat Santillana i altres materials.Biologia 2n Batxillerat. U02. Els bioelements, l'aigua i les sals minerals



Biologia 2n Batxillerat. U02. Els bioelements, l'aigua i les sals mineralsOriol Baradad
Őż
Presentació del tema 2 de l'assignatura de biologia de 2n de batxillerat.
Presentació preparada amb el llibre de 2n de Batxillerat Santillana i altres materials.Biologia 2n Batxillerat. U07. La cèl·lula. El nucli



Biologia 2n Batxillerat. U07. La cèl·lula. El nucliOriol Baradad
Őż
Presentació del tema 7 de l'assignatura de biologia de 2n de batxillerat.
Presentació preparada amb el llibre de 2n de Batxillerat Santillana i altres materials.Glucids i lipids ppt



Glucids i lipids pptN√ļria Guixa Boixereu
Őż
Repàs de Bioquímica de 1r de Batxillerat que entra a les PAAU (Biologia INS Tremp)La construcció de l'estat liberal. regències i guerra carlina. (1833 44)



La construcció de l'estat liberal. regències i guerra carlina. (1833 44)Rafa Oriola
Őż
La construcció de l'estat liberal. 1a part. Guerra carlina i Regències de Maria Cristina i Espartero. (1833-1844)Biologia 2n Batxillerat. U04. Els lípids



Biologia 2n Batxillerat. U04. Els lípidsOriol Baradad
Őż
Presentació del tema 4 de l'assignatura de biologia de 2n de batxillerat.
Presentació preparada amb el llibre de 2n de Batxillerat Santillana i altres materials.Exercicis de formulació orgànica amb solució



Exercicis de formulació orgànica amb solucióJose Maria Bleda Guerrero
Őż
nomenclatura orgànica con soluciónBiologia 2n Batxillerat. UD15. Alteracions de la informació genètica



Biologia 2n Batxillerat. UD15. Alteracions de la informació genèticaOriol Baradad
Őż
Presentació del tema 15 de l'assignatura de biologia de 2n de batxillerat.
Presentació preparada amb el llibre de 2n de Batxillerat Santillana i altres materials.Reaccions



ReaccionsLurdes Morral
Őż
Reaccions i estequiòmetria a 3r d'ESO. Basada en una presentació de Santillana.More Related Content
What's hot (20)
Biologia 2n Batxillerat. U06. Els àcids nucleics



Biologia 2n Batxillerat. U06. Els àcids nucleicsOriol Baradad
Őż
Presentació del tema 6 de l'assignatura de biologia de 2n de batxillerat.
Presentació preparada amb el llibre de 2n de Batxillerat Santillana i altres materials.Biologia 2n Batxillerat. U02. Els bioelements, l'aigua i les sals minerals



Biologia 2n Batxillerat. U02. Els bioelements, l'aigua i les sals mineralsOriol Baradad
Őż
Presentació del tema 2 de l'assignatura de biologia de 2n de batxillerat.
Presentació preparada amb el llibre de 2n de Batxillerat Santillana i altres materials.Biologia 2n Batxillerat. U07. La cèl·lula. El nucli



Biologia 2n Batxillerat. U07. La cèl·lula. El nucliOriol Baradad
Őż
Presentació del tema 7 de l'assignatura de biologia de 2n de batxillerat.
Presentació preparada amb el llibre de 2n de Batxillerat Santillana i altres materials.Glucids i lipids ppt



Glucids i lipids pptN√ļria Guixa Boixereu
Őż
Repàs de Bioquímica de 1r de Batxillerat que entra a les PAAU (Biologia INS Tremp)La construcció de l'estat liberal. regències i guerra carlina. (1833 44)



La construcció de l'estat liberal. regències i guerra carlina. (1833 44)Rafa Oriola
Őż
La construcció de l'estat liberal. 1a part. Guerra carlina i Regències de Maria Cristina i Espartero. (1833-1844)Biologia 2n Batxillerat. U04. Els lípids



Biologia 2n Batxillerat. U04. Els lípidsOriol Baradad
Őż
Presentació del tema 4 de l'assignatura de biologia de 2n de batxillerat.
Presentació preparada amb el llibre de 2n de Batxillerat Santillana i altres materials.Exercicis de formulació orgànica amb solució



Exercicis de formulació orgànica amb solucióJose Maria Bleda Guerrero
Őż
nomenclatura orgànica con soluciónBiologia 2n Batxillerat. UD15. Alteracions de la informació genètica



Biologia 2n Batxillerat. UD15. Alteracions de la informació genèticaOriol Baradad
Őż
Presentació del tema 15 de l'assignatura de biologia de 2n de batxillerat.
Presentació preparada amb el llibre de 2n de Batxillerat Santillana i altres materials.Similar to Ajustament de reaccions REDOX en medi àcid (9)
Reaccions



ReaccionsLurdes Morral
Őż
Reaccions i estequiòmetria a 3r d'ESO. Basada en una presentació de Santillana.More from David Mur (11)


Cinètica químicaDavid Mur
Őż
El documento habla sobre la cinética química y los factores que afectan la velocidad de las reacciones. Explica que la velocidad de una reacción depende de la concentración de los reactivos y del tiempo. También describe la teoría de las colisiones, en la que las moléculas deben chocar con suficiente energía para superar la energía de activación. Finalmente, detalla varios factores que influyen en la velocidad, como el estado físico de los reactivos, su concentración, la temperatura y la preAjustament de reaccions REDOX en medi àcid
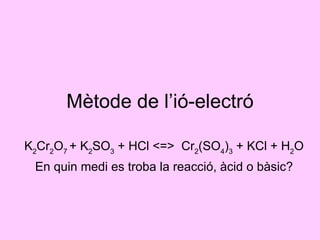
- 1. Mètode de l’ió-electró K 2 Cr 2 O 7 + K 2 SO 3 + HCl <=> Cr 2 (SO 4 ) 3 + KCl + H 2 O En quin medi es troba la reacció, àcid o bàsic?
- 2. K 2 Cr 2 O 7 + K 2 SO 3 + HCl <=> Cr 2 (SO 4 ) 3 + KCl + H 2 O +1 +6 -2 +1 +4 ‚Äď2 +1‚Äď1 +3 +6 -2 +1 -1 +1 -2 Troba els nombres d‚Äôoxidaci√≥ dels √†toms Escrivim la reacci√≥ en forma i√≤nica K + +Cr 2 O 7 2- +SO 3 2- +H + +Cl - <=> Cr 3+ +SO 4 2- +K + +Cl - + H 2 O
- 3. Escriu les semireaccions d’oxidació i reducció: Red Cr 2 O 7 2- <=> 2 Cr +3 Ox SO 3 2- <=> SO 4 2- Ajustem la massa: els O s’ajusten afegint H 2 O els H s’ajusten afegint H + Medi àcid ! Ox SO 3 2- + H 2 O <=> SO 4 2- + 2 H + Red Cr 2 O 7 2- + 14 H + < => 2 Cr +3 + 7 H 2 O
- 4. Ajustem les càrregues (electrons) Cr 2 O 7 2- + 14 H + + 6e - < => 2 Cr +3 + 7 H 2 O SO 3 2- + H 2 O <=> SO 4 2- + 2 H + + 2e- Cr 2 O 7 2- + 8 H + + 3 SO 3 2- < => 2 Cr +3 + 4 H 2 O + 3 SO 4 2- Sumem les semireaccions Cr 2 O 7 2- + 14 H + + 6e - < => 2 Cr +3 + 7 H 2 O 3 SO 3 2- + 3 H 2 O <=> 3 SO 4 2- + 6 H + + 6 e - 3x( )
- 5. Cr 2 O 7 2- + 8 H + + 3 SO 3 2- < => 2 Cr +3 + 4 H 2 O + 3 SO 4 2- K 2 Cr 2 O 7 + 8 HCl + 3 K 2 SO 3 < => Cr 2 (SO 4 ) 3 + 4 H 2 O + 8 KCl Afegim els contraions per escriure la reacció de forma molecular:

































