Problemas Redox
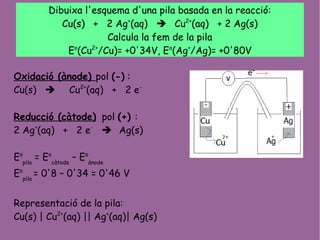
- 1. Dibuixa l'esquema d'una pila basada en la reacci├│: Cu(s) + 2 Ag+ (aq) ’ā© Cu2+ (aq) + 2 Ag(s) Calcula la fem de la pila Eo (Cu2+ /Cu)= +0'34V, Eo (Ag+ /Ag)= +0'80V Oxidaci├│ (├Ānode) pol (-) : Cu(s) ’ā© Cu2+ (aq) + 2 e- Reducci├│ (c├Ātode) pol (+) : 2 Ag+ (aq) + 2 e- ’ā© Ag(s) Eo pila = Eo c├Ātode ŌĆō Eo ├Ānode Eo pila = 0'8 ŌĆō 0'34 = 0'46 V Representaci├│ de la pila: Cu(s) | Cu2+ (aq) || Ag+ (aq)| Ag(s)
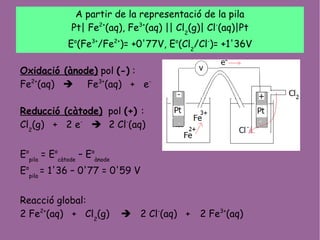
- 2. A partir de la representaci├│ de la pila Pt| Fe2+ (aq), Fe3+ (aq) || Cl2 (g)| Cl- (aq)|Pt Eo (Fe3+ /Fe2+ )= +0'77V, Eo (Cl2 /Cl- )= +1'36V Oxidaci├│ (├Ānode) pol (-) : Fe2+ (aq) ’ā© Fe3+ (aq) + e- Reducci├│ (c├Ātode) pol (+) : Cl2 (g) + 2 e- ’ā© 2 Cl- (aq) Eo pila = Eo c├Ātode ŌĆō Eo ├Ānode Eo pila = 1'36 ŌĆō 0'77 = 0'59 V Reacci├│ global: 2 Fe2+ (aq) + Cl2 (g) ’ā© 2 Cl- (aq) + 2 Fe3+ (aq)
- 3. Esquema, representaci├│, semireaccions, c├Ātode i ├Ānode, fem, moviment dels ions en el pont sal├Ł, polaritat del electrodes d'una pila que funcione amb Pb 2+ /Pb i amb Zn 2+ /Zn Eo (Pb2+ /Pb)= - 0'13V, Eo (Zn2+ /Zn)= - 0'76V. El parell redox de major potencial de reducci├│ ser├Ā el c├Ātode, cont├® l'oxidant m├®s fort, que es reduir├Ā. Ser├Ā el Pb2+ Reduci├│ (c├Ātode) pol (+) : Pb2+ (aq) + 2 e- ’ā© Pb(s) Oxidaci├│ (├Ānode) pol (-) : Zn(s) ’ā© Zn2+ (aq) + 2 e- Eo pila = Eo c├Ātode ŌĆō Eo ├Ānode = -0'13 - (-0'76) = 0'63 V Representaci├│ de la pila: Zn(s) | Zn2+ (aq) || Pb2+ (aq)| Pb(s) Reacci├│ global: Pb2+ (aq) + Zn(s) ’ā© Zn2+ (aq) + Pb(s)
- 4. Indica els agents oxidant i reductor m├®s forts: Fe3+ , NO3 - , H2 O2 , Ag, Cl- , Eo (Cl2 /Cl- )= +1'36 V, Eo (O2 /H2 O2 )= +0'68 V, Eo (Ag+ /Ag)= +0'80 V, Eo (Fe3+ /Fe2+ )= +0'77 V, Eo (H2 O2 /H2 O)= +1'77 V, Eo (NO3 - /NO)= +0'96 V, Primerament identificarem les esp├©cies que poden actuar com a oxidants (poden disminuir el seu Nox) i les esp├©cies que poden actuar com a reductors (poden augmentar el seu Nox). Oxidants: Fe3+ , NO3 - , H2 O2 Reductors: H2 O2 , Ag, Cl- S'observa que el H2 O2 pot actuar de les dues formes. L'oxidant m├®s fort ser├Ā el de major potencial de reducci├│ ( NO3 - > H2 O2 > Fe3+ ). El reductor m├®s fort ser├Ā el de menor potencial de reducci├│:(H2 O2 > Ag > Cl- ) Nota: Hem considerat que el NO3 - i el H2 O2 es troben en medi ├Ācid, ja que el seu potencial dep├©n de [H+ ]
- 5. Prediu si les seg├╝ents reaccions s├│n espont├Ānias en el sentit en el que estan escrites les equacions: a) Cl2 (g) + 2 Br- (aq) ’ā© 2Cl- (aq) + Br2 (g) b) Zn2+ (aq) + Sn(s) ’ā© Zn(s) Sn2+ (aq) c) 2 H+ (aq) + 2 I- (aq) ’ā© H2 (g) + I2 (aq) L'espontane├»tat est├Ā determinada per Oxidant m├®s fort + Reductor m├®s fort ’ā© Oxidant m├®s d├©bil + Reductor m├®s d├©bil Sent l'oxidant m├®s fort l'esp├©cie amb m├®s tend├©ncia a reduir- se o siga la d'un potencial de reducci├│ m├®s alt I el reductor m├®s fort l'esp├©cia amb m├®s tend├©ncia a oxidar- se o siga la d'un potencial de reducci├│ m├®s baix. Tamb├® poden determinar l'espontane├»tat calculant la fem de la possible pila que es formaria. Si Epila > 0 ser├Ā espont├Ānia.
- 6. a) Eo (Cl2 /Cl- )= +1'36V, Eo (Br2 /Br- )= +1'07V El Cl2 ├®s l'oxidant m├®s fort i el Br- el reductor m├®s fort Cl2 (g) + 2 Br- (aq) ’ā© 2Cl- (aq) + Br2 (g) espont├Ānia A m├®s Cl2 ’āĀCl- (c├Ātode) i Br- ’āĀBr2 (├Ānode) Epila = 1'36-1'07= 0'29V b) Eo (Zn2+ /Zn)= -0'76V, Eo (Sn2+ /Sn)= - 0'14V El Sn2+ ├®s l'oxidant m├®s fort i el Zn el reductor m├®s fort. Zn2+ (aq) + Sn(s) ’ā© Zn(s) + Sn2+ (aq) no espont├Ānia A m├®s Zn2+ ’āĀZn (c├Ātode) i Sn’āĀSn2+ (├Ānode) Epila = -0'76-(-0'14)= -0'62V c) Eo (I2 /I- )= +0'54V, Eo (H+ /H2 )= 0V El I2 ├®s l'oxidant m├®s fort i el H2 el reductor m├®s fort 2 H+ (aq) + 2 I- (aq) ’ā© H2 (g) + I2 (aq) no espont├Ānia A m├®s H+ ’āĀH2 (c├Ātode) i I- ’āĀI2 (├Ānode) Epila = 0-0'54= -0'54V
- 7. Indica quina/es de les seg├╝ents esp├©cies (F- , Cl2 , H+ , Cu2+ , Fe2+ i Zn2+ ) pot oxidar als ions I- a I2 . Eo (Cl2 /Cl- )= +1'36 V, Eo (F2 /F- )= +2'87 V, Eo (Cu2+ /Cu)= +0'34 V, Eo (Fe3+ /Fe2+ )= +0'77 V, Eo (Zn2+ /Zn)= -0'76 V, Eo (Fe2+ /Fe)= -0'44 V, Eo (I2 /I- )= +0'54 V Per a oxidar als ions I- necessiten un oxidant, primerament e independent del seu potencial hem d'eliminar les esp├©cies que siguen reductores. El F- ├®s un reductor. El Fe2+ pot actuar com a reductor i oxidar-se a Fe3+ , per├▓ tamb├© pot actuar com a oxidant i reduir-se a Fe. Poden oxidar als ions I- els oxidants que tinguen un potencial de reducci├│ major que el de par Eo (I2 /I- )= +0'54 V. Observant els valors deduim que nom├®s el Cl2 podria oxidar als ions I- . Nota: El Fe2+ no pot oxidar al I- ,per├▓ el Fe3+ si que podria.
- 8. Raona qu├© passar├Ā si: a)Agitem una dissoluci├│ de Fe3+ amb una cullera de plata b) Mesclem una dissoluci├│ de Ag + amb una dissoluci├│ de Zn 2+ c) Agitem una dissoluci├│ de HCl amb una cullera de coure. d) Removem una dissoluci├│ de HNO 3 amb una vareta de coure. Eo (Cl2 /Cl- )= +1'36 V, Eo (Cu2+ /Cu)= +0'34 V, Eo (Ag+ /Ag)= +0'80 V, Eo (Fe3+ /Fe2+ )= +0'77 V, Eo (Zn2+ /Zn)= -0'76 V, Eo (NO3 - /NO)= +0'96 V, En tots els casos per a que passe alguna cosa (hi haja reacci├│) caldr├Ā que reaccionen un oxidant amb un reductor i que el potencial de reducci├│ de l'oxidant (c├Ātode) siga major que el potencial de reducci├│ del reductor (├Ānode) a) El Fe 3+ ├®s un oxidant i la Ag un reductor per├▓ com Eo (Fe3+ /Fe2+ )= +0'77 V < Eo (Ag+ /Ag)= +0'80 V, no hi ha reacci├│ b) Tant el Ag + com el Zn 2+ s├│n nom├®s oxidants. No hi ha reacci├│.
- 9. c) La dissoluci├│ de HCl cont├® un oxidant el H+ i un reductor el Cl- . El Cu ├®s un reductor i nom├®s podria reaccionar amb el H+ per├▓ com Eo (H+ /H2 )= 0'0 V < Eo (Cu2+ /Cu)= +0'34 V. No hi ha reacci├│ d) La dissoluci├│ de HNO3 cont├® dos oxidants el H+ i el NO3 - , qualsevol dels dos podria oxidar al Cu. Ja hem vist en c) que el H+ no podia, per├▓ com Eo (NO3 - /NO)= +0'96 V > Eo (Cu2+ /Cu)= +0'34 V Si que hi ha reacci├│. Nota: El potencial del NO3 - dep├®n del pH, i el valor de 0'96 V ├®s en medi ├Ācid. Una sal de NaNO3 , amb un pH=7 no donaria un potencial per al nitrat tant elevat i possiblement no reaccionaria amb el Cu.
- 10. Indica qu├© es forma al c├Ātode i a l'├Ānode durant l'electr├▓lisi de: a) Sal fosa de NaCl b) Dissoluci├│ aquosa de NaNO3 c) Dissoluci├│ aquosa de AgI d) Dissoluci├│ aquosa de CuF2 e) Dissoluci├│ aquosa de MgSO4 utilitzant electrodes de Cu. Durant l'electrolis es descarrega al c├Ātode (pol -) el cati├│ m├®s oxidant (del de major potencial) I a l'├Ānode (pol +) l'ani├│ m├®s reductor (el de menor potencial). En aquest proc├©s entran en compet├©ncia tant els ions de la sal com els del dissolvent e incl├▓s l'electrode met├Āl┬Ęlic utilitzat com ├Ānode pot oxidar-se. a) NaCl ’ā© Na+ + Cl- C├Ātode (-): Na+ + 1 e- ’ā© Na ├Ćnode (+): 2 Cl- ’ā© Cl + 2e-
- 11. b) NaNO3 ’ā© Na+ + NO3 - A m├®s l'aigua proporciona H2 O ’ā© H+ + OH- C├Ātode es descarrega l'i├│ positiu (Na+ o H+ ) m├®s oxidant. Com Eo (H+ /H2 )=-0'42V > Eo (Na+ /Na)=-2'71V, es descarregar├Ā H+ 2H+ + 2e- ’ā© H2 ├Ćnode es descarrega l'i├│ negatiu (NO3 - o OH- ), per├▓ l'i├│ nitrat NO3 - no pot oxidar-se m├®s, per tant es descarregar├Ā OH-. 4OH- ’ā© O2 + H2 O + 4e- c) AgI Ag+ + I- A m├®s l'aigua proporciona H2 O ’ā© H+ + OH-
- 12. C├Ātode es descarrega l'i├│ positiu (Ag+ o H+ ) m├®s oxidant. Com Eo (Ag+ /Ag)=+0'80V > Eo (H+ /H2 )=-0'42V, es descarregar├Ā Ag+ Ag+ + e- ’ā© Ag ├Ćnode es descarrega l'i├│ negatiu (I- o OH- ) m├®s reductor. Com Eo (I2 /I- )= +0'54V < Eo (O2 /OH- )=+0'81V, es descarregar├Ā I- 2I- ’ā© I2 + 2e- d) CuF2 ’ā© Cu2+ + 2F- A m├®s l'aigua proporciona H2 O ’ā© H+ + OH- C├Ātode es descarrega l'i├│ positiu (Cu2+ o H+ ) m├®s oxidant. Com Eo (Cu2+ /Cu)=0'34V > Eo (H+ /H2 )=-0'42V, es descarregar├Ā Cu2+ Cu2+ + 2e- ’ā© Cu
- 13. ├Ćnode es descarrega l'i├│ negatiu (F- o OH- ), m├®s reductor. Com Eo (O2 /OH- )=+0'81V < Eo (F2 /F- )= +2'87V , es descarregar├Ā OH- 4OH- ’ā© O2 + H2 O + 4e- e) MgSO4 ’ā© Mg2+ + SO4 2- A m├®s l'aigua proporciona H2 O ’ā© H+ + OH- C├Ātode es descarrega l'i├│ positiu (Mg2+ o H+ ) m├®s oxidant. Com Eo (H+ /H2 )=-0'42V > Eo (Mg2+ /Mg)=-2'37V, es descarregar├Ā H+ 2H+ + 2e- ’ā© H2 ├Ćnode es descarrega l'i├│ negatiu (SO4 2- o OH- ) m├®s reductor u oxidar-se l'electrode de Cu. El SO4 2- no pot descarregar-se ja que no pot oxidar-se m├®s. Com Eo (Cu2+ /Cu)= +0'34V < Eo (O /OH- )=+0'81V, s'oxida el Cu
- 14. Per dos cisternes electrol├Łtiques conectades en s├©rie circula la mateixa c├Ārrega.Si en la 1┬¬ es descarreguen 0'4 mol de Zn2+ ┬┐quants mols d'Al3+ es descarreguen en la 2┬¬? Les semireaccions de desc├Ārrega del Zn2+ i de l'Al3+ s├│n: Zn2+ + 2e- ŌåÆ Zn Al3+ + 3e- ŌåÆ Al I seguint l'estequiometria Com circula la mateixa c├Ārrega Q, si dividim les dos expressions: Q n F Almol Q n F Znmol AlZn ++ =Ōćö= ++ 32 3 1 2 1 32 + ==ŌćÆ= + + + 3 27'0 3 4'0┬Ę2 3 2 3 2 3 Almoln n n Al Zn Al
- 15. Per una cisterna que cont├® CaCl2 fos, passa un corrent de 0ŌĆÖ452 A durant 1ŌĆÖ5 hores. Descriu els processos que tenen lloc al c├Ātode i a l'├Ānode i calcula la massa de Ca que es dipositar├Ā i el volum de Cl2 en C.N. Que s'alliberar├Ā. Al c├Ātode es produir├Ā la reducci├│ del Ca2+ Ca2+ + 2e- ŌåÆ Ca La c├Ārrega Q que circula ├®s Q= I┬Ęt = 0ŌĆÖ452 ┬Ę 1ŌĆÖ5 ┬Ę 3600 = 2440ŌĆÖ8 C Seguint l'estequiometria es compleix CadegMnm Cademoln n Q n F Camol r 505'01'40┬Ę0126'0┬Ę 0126'0 8'244096500┬Ę2 1 2 1 === =ŌćÆ=ŌćÆ=
- 16. A l'├Ānode es produir├Ā l'oxidaci├│ del Cl- : 2 Cl- + 2e- ŌåÆ Cl2 Seguint l'estequiometria es compleix 2 2 2 28'04'22┬Ę0126'0/4'22┬Ę 0126'0 8'244096500┬Ę2 1 2 1 CldeLmolLnV Cldemoln n Q n F Clmol === =ŌćÆ=ŌćÆ=
- 17. En l'electr├▓lisi d'una dissoluci├│ aquosa de CuSO4 . Calcula: a) El temps que ha de circular un corrent de 2 A per a que es dipositen 25 g de Cu. b) Volum d'oxigen que s'allibera a 25┬║C i 1 atm Al c├Ātode es descarrega el Cu2+ Cu2+ + 2e- ŌåÆ Cu Segons l'estequiometria es compleix: s I Q ttIQ CQ Q mol F Cumol Cumol mol g g M m n Q n F Cumol Cu Cu Cu 37635 2 75270 ;┬Ę 7527039'0┬Ę96500┬Ę2; 39'0 2 1 39'0 5'63 25 ; 2 1 ==== === ====
- 18. A l'├Ānode es descarrega el OH- 4OH- ’ā© O2 + H2 O + 4e- Seguint l'estequiometria es compleix 2 2 2 8'4 1 298┬Ę082'0┬Ę195'0┬Ę┬Ę 195'0 7527096500┬Ę4 1 4 1 2 2 2 22 OL P TRn V Odemoln n Q n F Omol O O O OO === =ŌćÆ=ŌćÆ=

![Indica els agents oxidant i reductor m├®s forts: Fe3+
, NO3
-
,
H2
O2
, Ag, Cl-
,
Eo
(Cl2
/Cl-
)= +1'36 V, Eo
(O2
/H2
O2
)= +0'68 V, Eo
(Ag+
/Ag)= +0'80 V,
Eo
(Fe3+
/Fe2+
)= +0'77 V, Eo
(H2
O2
/H2
O)= +1'77 V, Eo
(NO3
-
/NO)= +0'96 V,
Primerament identificarem les esp├©cies que poden actuar com a
oxidants (poden disminuir el seu Nox) i les esp├©cies que poden actuar
com a reductors (poden augmentar el seu Nox).
Oxidants: Fe3+
, NO3
-
, H2
O2
Reductors: H2
O2
, Ag, Cl-
S'observa que el H2
O2
pot actuar de les dues formes.
L'oxidant m├®s fort ser├Ā el de major potencial de reducci├│ ( NO3
-
>
H2
O2
> Fe3+
). El reductor m├®s fort ser├Ā el de menor potencial de
reducci├│:(H2
O2
> Ag > Cl-
)
Nota: Hem considerat que el NO3
-
i el H2
O2
es troben en medi ├Ācid, ja
que el seu potencial dep├©n de [H+
]](https://image.slidesharecdn.com/problemesredox-150406094943-conversion-gate01/85/Problemas-Redox-4-320.jpg)