Bat2 1 termodinamica
- 1. ░šĘĪĖķ▓č░┐Č┘▒§▒Ę├Ć▓č▒§░õ┤Ī Principis b├Āsics 2n Batxillerat INS Frederic Mompou Curs 2012-2013
- 2. ░šĘĪĖķ▓č░┐Č┘▒§▒Ę├Ć▓č▒§░õ┤Ī Estudi dels fen├▓mens i transformacions energ├©tiques en qu├© intervenen calor + temperatura Energia que es transfereix dŌĆÖun cos a un altre com a Magnitud f├Łsica conseq├╝├©ncia de la proporcional a lŌĆÖenergia difer├©ncia de temperatures interna dels cossos entre ells. (Ecin├©tica de les seves mol├©cules). El cos que absorbeix calor Es mesura en Kelvin (zero incrementa lŌĆÖenergia de les absolut = -273 ┬║C). seves part├Łcules. Es mesura en J o en cal.
- 4. CALOR ESPEC├ŹFICA La quantitat de Q cedida o absorbida per un cos per variar la seva temperatura dep├©n de: Massa del cos (m) Tipus de subst├Āncia que el constitueix (Ce) Variaci├│ de temperatures inicial i final (T2-T1) Q = m┬ĘCe┬Ę(T2ŌĆōT1) Ce: calor espec├Łfica dŌĆÖuna subst├Āncia Quantitat dŌĆÖenergia que cal subministrar a 1g de subst├Āncia per elevar la seva temperatura 1 grau. [J/g┬ĘK] Conveni de signes: Q absobida: + Q cedida: -
- 5. CALOR LATENT Absorci├│ de Q provoca augment de T, o Fusi├│: de s├▓lid a l├Łquid canvi de fase (sense augment de T) Vaporitzaci├│: de l├Łquid a gas Durant un canvi de fase, lŌĆÖenergia que rep el cos es destina a augmentar lŌĆÖenergia cin├©tica de les seves mol├©cules per tal de realitzar el canvi de fase. calor de fusi├│ Qf = m┬ĘLf calor dŌĆÖevaporaci├│ Qv = m┬ĘLv Lf: calor latent de fusi├│ Lv: calor latent de vaporitzaci├│ [kJ/kg] Calor latent: quantitat de calor necess├Āria per efectuar el canvi de fase dŌĆÖ1 g de subst├Āncia
- 6. PODER CALOR├ŹFIC La quantitat de Q subministrada per la combusti├│ dŌĆÖun combustible dep├®n de: Quantitat de combustible (q = massa o volum) Tipus de combustible (PC) Rendiment del cremador (Ų×) Q = q ┬Ę PC ┬Ę Ų× PC: poder calor├Łfic dŌĆÖun combustible Quantitat dŌĆÖenergia que despr├®n la combusti├│ dŌĆÖ1 unitat de combustible (1 g o 1 m3) [kJ/kg, kJ/m3] Poder calor├Łfic dels gasos: dep├®n de la Temperatura (T) i la Pressi├│ (P) Condicions normals (CN): Temperatura: TCN = 0┬║C (273 K) PC = PCCN ┬Ę P/PCN ┬Ę TCN/T [K] Pressi├│: PCN = 1 atm (101.300 Pa)
- 9. LLEIS DELS GASOS PERFECTES Gas: estat de la mat├©ria en qu├© les mol├©cules que el componen resten poc lligades entre elles per les forces de cohesi├│. No presenta ni forma ni volum definits. S├│n els cossos en els quals m├®s es manifesten els efectes termodin├Āmics a baixes temperatures. Aix├▓ ├®s a causa de la seva activitat molecular a temperatura ambient.
- 10. Lleis dels gasos perfectes relacionen pressi├│ i volum amb temperatura Llei de Boyle-Mariotte: a T constant: p1┬ĘV1 = p2┬ĘV2 = p3┬ĘV3 = constant Llei de Gay-Lussac o Llei de Charles: (p1 ┬Ę V1) / T1 = (p2 ┬Ę V2) / T2 = (p3 ┬Ę V3) / T3 = constant
- 11. Lleis dels gasos perfectes E12. Dins dŌĆÖun cilindre hi ha aire a 18 ┬║C amb un volum inicial dŌĆÖ1L a 1 atm de pressi├│. Si desplacem lŌĆÖ├©mbol de manera que el volum es redueixi a 1/8 part del volum inicial i la temperatura sŌĆÖincrementi en 5 ┬║C, determina la pressi├│ final. Considerem lŌĆÖaire un gas ideal o perfecte.
- 13. Lleis dels gasos perfectes relacionen pressi├│ i volum amb temperatura Llei de Boyle-Mariotte: a T constant: p1┬ĘV1 = p2┬ĘV2 = p3┬ĘV3 = constant Llei de Gay-Lussac: (p1 ┬Ę V1) / T1 = (p2 ┬Ę V2) / T2 = (p3 ┬Ę V3) / T3 = constant (k) k = n┬ĘR Equaci├│ dŌĆÖestat dels gasos perfectes: p┬ĘV = k┬ĘT = n┬ĘR┬ĘT P: pressi├│ de la massa del gas (Pa) V: volum (m3) T: temperatura absoluta (K) n: n├║m de mols dŌĆÖun gas ideal R: constant universal dels gasos ideals R = 8,314 J/ K mol (per a tots els gasos)
- 14. Lleis dels gasos perfectes relacionen pressi├│ i volum amb temperatura E13. Determina la pressi├│ p a la qual es troba una massa m = 1 kg dŌĆÖox├Łgen (O2) a T = 40 ┬║C si ├®s dins dŌĆÖun recipient de V = 25 L (un mol dŌĆÖox├Łgen t├® una massa de 32 g) Un mol ├®s una quantitat de mat├©ria determinada que cont├® 6,02┬Ę1023 mol├©cules, xifra que rep el nom de nombre dŌĆÖAvogadro. Aix├Ł doncs, la massa molar ├®s la massa molecular expressada en grams. Un mol de qualsevol subst├Āncia gasosa ocupa en condicions normals (0 ┬║C i 1 atm) un volum de 22,4 L.
- 15. Primer principi de la termodin├Āmica (principi de conservaci├│ de lŌĆÖenergia) U: energia interna del cos (Energia t├©rmica) Conseq├╝├©ncia de la seva activitat molecular Ecos = U + E [J] E: altres formes dŌĆÖenergia degudes a la seva posici├│ dins dŌĆÖun camp de forces (gravitacional, el├©ctric, magn├©tic) i al seu moviment en conjunt. LŌĆÖenergia interna dŌĆÖun sistema (╬öU) variar├Ā si es realitza treball sobre el sistema (W) ╬öU = Q + W o b├® aquest intercamvia calor amb un altre (Q) ╬öU = Variaci├│ dŌĆÖenergia interna que pateix el sistema Q = Calor que entra (+) o surt (-) dŌĆÖun sistema W = Treball fet (+) o rebut (-) pel sistema
- 16. Primer principi de la termodin├Āmica (principi de conservaci├│ de lŌĆÖenergia) E14. Un recipient a├»llat del seu entorn amb un volum V = 3 L dŌĆÖaigua cau des de h = 100 m dŌĆÖal├¦ada i xoca inel├Āsticament amb el terra. Si la temperatura inicial de lŌĆÖaigua era T1 = 15 ┬║C, quina ser├Ā la variaci├│ de la seva energia interna ╬öU? I la seva temperatura T2 despr├®s del xoc? ╬öU = Q + W
- 17. Primer principi de la termodin├Āmica (principi de conservaci├│ de lŌĆÖenergia) E15. Un cilindre amb un ├©mbol cont├® un volum V = 10 L dŌĆÖaigua i es col┬Ęloca el conjunt sobre una estufa. Durant el proc├®s es transfereixen Q1 = 100 kJ a lŌĆśaigua, mentre que a trav├®s de les parets es produeixen unes p├©rdues equivalents a Q2 = 25 kJ. LŌĆÖ├©mbol puja com a conseq├╝├©ncia de la dilataci├│ de lŌĆÖaigua i fa un treball equivalent a W = 15 kJ. Determina la variaci├│ de lŌĆÖenergia ╬öU de lŌĆÖaigua en el proc├®s i la temperatura ╬öU = Q + W final T2 de lŌĆÖaigua si la temperatura inicial era T1 = 18 ┬║C (Ce aigua = 4,18 kJ/kg┬║C)
- 18. Primer principi de la termodin├Āmica (principi de conservaci├│ de lŌĆÖenergia) ╬öU = Q + W
- 19. Primer principi de la termodin├Āmica (principi de conservaci├│ de lŌĆÖenergia) ╬öU = Q + W
- 20. Treball fet per un gas Quan sŌĆÖestudia el treball que realitza un gas, cal tenir en compte qu├© els gassos solen estar tancats a pressi├│ dins dŌĆÖun cilindre i el despla├¦ament qu├© es produeix ├®s el dŌĆÖun pist├│. p=F/S V=S┬ĘŌłåx W = F ┬Ę Ōłåx = p ┬Ę V Per tant: en comptes de for├¦a es treballa amb pressi├│, i en comptes de despla├¦ament es treballa amb volum.
- 21. Treball fet per un gas
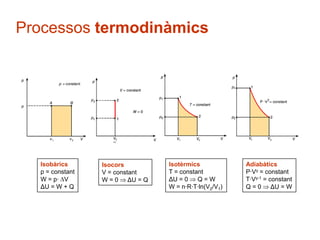
- 22. Processos termodin├Āmics Sobre el gas a lŌĆÖinterior dŌĆÖun cilindre es pot variar la seva pressi├│, temperatura i volum. En la transformaci├│ el gas rebre o perdre calor, o pot variar la seva energia interna: realitzar o absorvir un treball DŌĆÖacord amb les condicions de variaci├│ de volum, pressi├│ i temperatura, poden donar-se els processos termodin├Āmics seg├╝ents: processos isob├Ārics processos isocors processos isot├©rmics processos adiab├Ātics
- 23. Processos isob├Ārics Processos termodin├Āmics durant els quals p = constant P. ex: lŌĆÖexpansi├│ de lŌĆÖaire dins dŌĆÖun cilindre pneum├Ātic p1 = p2 V1/T1 = V2/T2 For├¦a exercida pel sistema: F = p┬ĘA [N] Treball fet pel gas: W = F┬Ęx = p┬ĘA┬Ęx = p┬Ę V [J] W Diagrama pV Representaci├│ gr├Āfica del W
- 24. Processos isob├Ārics E16. Determina la for├¦a F i el treball W que realitzar├Ā un cilindre pneum├Ātic de ├Ė 16 mm que es despla├¦a 150 mm. La pressi├│ del sistema ├®s de 6 bar i rom├Ān constant durant tot el proc├®s.
- 26. Processos isocors Processos termodin├Āmics durant els quals V = constant W = p ┬Ę V = 0 (no hi ha cap despla├¦ament) La Q subministrada al sistema es transforma en ╬öU V1 = V2 p1/T1 = p2/T2 Diagrama pV W = p┬ĘV = 0 ╬öU = Q P. ex: quan es deixa un recipient de parets r├Łgides amb un gas al seu interior en contacte amb una font W=0 de calor, com ara una bombona de but├Ā al sol. La calor subministrada augmenta lŌĆÖenergia interna del gas, que es tradueix en un increment de temperatura i, per tant, tamb├® de pressi├│.
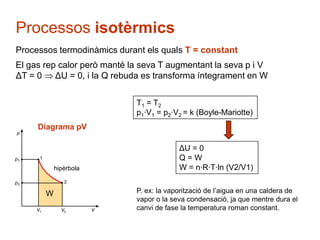
- 27. Processos isot├©rmics Processos termodin├Āmics durant els quals T = constant El gas rep calor per├▓ mant├® la seva T augmentant la seva p i V ╬öT = 0 ╬öU = 0, i la Q rebuda es transforma ├Łntegrament en W T1 = T2 p1┬ĘV1 = p2┬ĘV2 = k (Boyle-Mariotte) Diagrama pV ╬öU = 0 Q=W hip├©rbola W = n┬ĘR┬ĘT┬Ęln (V2/V1) W P. ex: la vaporitzaci├│ de lŌĆÖaigua en una caldera de vapor o la seva condensaci├│, ja que mentre dura el canvi de fase la temperatura roman constant.
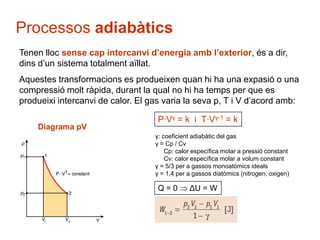
- 28. Processos adiab├Ātics Tenen lloc sense cap intercanvi dŌĆÖenergia amb lŌĆÖexterior, ├®s a dir, dins dŌĆÖun sistema totalment a├»llat. Aquestes transformacions es produeixen quan hi ha una expasi├│ o una compressi├│ molt r├Āpida, durant la qual no hi ha temps per que es produeixi intercanvi de calor. El gas varia la seva p, T i V dŌĆÖacord amb: P┬ĘV╬│ = k i T┬ĘV╬│-1 = k Diagrama pV ╬│: coeficient adiab├Ātic del gas ╬│ = Cp / Cv Cp: calor espec├Łfica molar a pressi├│ constant Cv: calor espec├Łfica molar a volum constant ╬│ = 5/3 per a gassos monoat├▓mics ideals ╬│ = 1,4 per a gassos diat├▓mics (nitrogen, oxigen) Q=0 ╬öU = W
- 29. Processos termodin├Āmics Isob├Ārics Isocors Isot├©rmics Adiab├Ātics p = constant V = constant T = constant P┬ĘV╬│ = constant W = p┬Ę V W = 0 ╬öU = Q ╬öU = 0 Q=W T┬ĘV╬│-1 = constant ╬öU = W + Q W = n┬ĘR┬ĘT┬Ęln(V2/V1) Q = 0 ╬öU = W
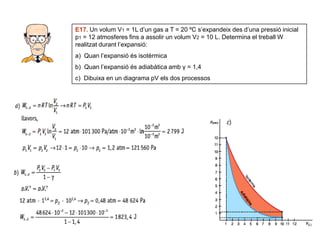
- 30. E17. Un volum V1 = 1L dŌĆÖun gas a T = 20 ┬║C sŌĆÖexpandeix des dŌĆÖuna pressi├│ inicial p1 = 12 atmosferes fins a assolir un volum V2 = 10 L. Determina el treball W realitzat durant lŌĆÖexpansi├│: a) Quan lŌĆÖexpansi├│ ├®s isot├©rmica b) Quan lŌĆÖexpansi├│ ├®s adiab├Ātica amb ╬│ = 1,4 c) Dibuixa en un diagrama pV els dos processos
- 34. Dubtes??

![CALOR ESPEC├ŹFICA
La quantitat de Q cedida o absorbida per un cos per variar la seva
temperatura dep├©n de:
Massa del cos (m)
Tipus de subst├Āncia que el constitueix (Ce)
Variaci├│ de temperatures inicial i final (T2-T1)
Q = m┬ĘCe┬Ę(T2ŌĆōT1)
Ce: calor espec├Łfica dŌĆÖuna subst├Āncia
Quantitat dŌĆÖenergia que cal subministrar a 1g
de subst├Āncia per elevar la seva temperatura
1 grau. [J/g┬ĘK]
Conveni de signes:
Q absobida: + Q cedida: -](https://image.slidesharecdn.com/bat21termodinamica-120927053711-phpapp01/85/Bat2-1-termodinamica-4-320.jpg)
![CALOR LATENT
Absorci├│ de Q provoca
augment de T, o
Fusi├│: de s├▓lid a l├Łquid
canvi de fase (sense augment de T)
Vaporitzaci├│: de l├Łquid a gas
Durant un canvi de fase, lŌĆÖenergia que rep el cos es destina a
augmentar lŌĆÖenergia cin├©tica de les seves mol├©cules per tal
de realitzar el canvi de fase.
calor de fusi├│ Qf = m┬ĘLf
calor dŌĆÖevaporaci├│ Qv = m┬ĘLv
Lf: calor latent de fusi├│
Lv: calor latent de vaporitzaci├│ [kJ/kg]
Calor latent:
quantitat de calor necess├Āria per efectuar el canvi de fase dŌĆÖ1 g de subst├Āncia](https://image.slidesharecdn.com/bat21termodinamica-120927053711-phpapp01/85/Bat2-1-termodinamica-5-320.jpg)
![PODER CALOR├ŹFIC
La quantitat de Q subministrada per la combusti├│ dŌĆÖun combustible
dep├®n de:
Quantitat de combustible (q = massa o volum)
Tipus de combustible (PC)
Rendiment del cremador (Ų×)
Q = q ┬Ę PC ┬Ę Ų×
PC: poder calor├Łfic dŌĆÖun combustible
Quantitat dŌĆÖenergia que despr├®n la combusti├│
dŌĆÖ1 unitat de combustible (1 g o 1 m3) [kJ/kg, kJ/m3]
Poder calor├Łfic dels gasos: dep├®n de la Temperatura (T) i la Pressi├│ (P)
Condicions normals (CN):
Temperatura: TCN = 0┬║C (273 K)
PC = PCCN ┬Ę P/PCN ┬Ę TCN/T [K]
Pressi├│: PCN = 1 atm (101.300 Pa)](https://image.slidesharecdn.com/bat21termodinamica-120927053711-phpapp01/85/Bat2-1-termodinamica-6-320.jpg)







![Primer principi de la termodin├Āmica
(principi de conservaci├│ de lŌĆÖenergia)
U: energia interna del cos (Energia t├©rmica)
Conseq├╝├©ncia de la seva activitat molecular
Ecos = U + E [J]
E: altres formes dŌĆÖenergia degudes a la seva posici├│
dins dŌĆÖun camp de forces (gravitacional, el├©ctric,
magn├©tic) i al seu moviment en conjunt.
LŌĆÖenergia interna dŌĆÖun sistema (╬öU) variar├Ā
si es realitza treball sobre el sistema (W) ΔU = Q + W
o b├® aquest intercamvia calor amb un altre (Q)
╬öU = Variaci├│ dŌĆÖenergia interna que pateix el sistema
Q = Calor que entra (+) o surt (-) dŌĆÖun sistema
W = Treball fet (+) o rebut (-) pel sistema](https://image.slidesharecdn.com/bat21termodinamica-120927053711-phpapp01/85/Bat2-1-termodinamica-15-320.jpg)






![Processos isob├Ārics
Processos termodin├Āmics durant els quals p = constant
P. ex: lŌĆÖexpansi├│ de lŌĆÖaire dins dŌĆÖun cilindre pneum├Ātic
p1 = p2
V1/T1 = V2/T2
For├¦a exercida pel sistema:
F = p┬ĘA [N]
Treball fet pel gas:
W = F┬Ęx = p┬ĘA┬Ęx = p┬Ę V [J]
W Diagrama pV
Representaci├│ gr├Āfica del W](https://image.slidesharecdn.com/bat21termodinamica-120927053711-phpapp01/85/Bat2-1-termodinamica-23-320.jpg)




































![Circuitos rlc pri[1]](https://cdn.slidesharecdn.com/ss_thumbnails/circuitosrlcpri1-110724132551-phpapp02-thumbnail.jpg?width=560&fit=bounds)
















































