Stoikiometri
- 1. S T O I K I O M E T R I OLEH : Srigustinawati Sinaga PENDIDIKAN KIMIA PPs UNIMED 2013
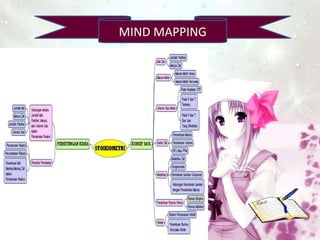
- 2. MIND MAPPING
- 3. STOIKIOMETRI KONSEP MOL PERHITUNGAN KIMIA
- 4. KONSEP MOL Mol Zat Massa Molar Volume Gas Molar Kadar Zat Molaritas Penentuan Rumus Kimia Hidrat
- 5. Mol Zat Satuan mol zat adalah banyaknya zat tersebut yang mengandung partikel elementer (atom, molekul, dan ion) sebanyak bilangan Avogadro 6.02 x 1023 partikel. Jumlah mol biasanya dinyatakan dengan lambang n.
- 6. jumlahp artikel 6.02 x 10 partikel/mol mol jumlahp artikel x 23 n ï― 6.02 x 10 partikel 23 n ï―
- 7. Menghitung jumlah mol jika diketahui massa, Mr, Ar gr Mr/Ar n ï― n = mol gr = massa Mr/Ar= massa atom/molekul relatif
- 8. 8 STOIKIOMETRI 1 mol = 6,02 x 1023 (Avogadro) ïBerapa jumlah mol dari 2,4 gram Mg ? Jawab: (Ar Mg = 24) 0,1 mol 2,4 mol ï― ï― ï― 24 g Ar ïBerapa jumlah mol dari 1,2 gram MgSO4 ? Jawab: (Ar Mg = 24, S = 32, O = 16) 0,01 mol 1,2 mol ï― (24 x 1) (32 x 1) (16 x 4) g Mr ïŦ ïŦ ï― ï―
- 9. Massa Molar Massa molar adalah massa satu mol suatu zat dalam satuan gram. Massa molar = jumlah Ar atom unsur Massa molar = jumlah Mr senyawa
- 10. Volume Molar Volume molar adalah Pada Keadaan STP Volume 1 mol gas 0o C, 1 atm (STP) = 22,4 L volume 1 mol gas. v ï― n x 22,4
- 11. Pada P dan T Tertentu PV ï― nRT P = tekanan gas (atm) V = volume gas R = tetapan gas = 0,082 L atm/mol K T = suhu (Kelvin)
- 12. Pada P dan T Gas Lain Diketahui 1 2 V 1 V 2 n n ï― V1 = Volume gas 1 V2 = Volume gas 2 n1 = jumlah mol gas 1 n2 = jumlah mol gas 2
- 13. Kadar Zat Persentase Massa Persentase Volume Bpj atau ppm
- 14. Persentase Massa âĒ Persen massa menyatakan jumlah gram zat terlarut dalam seratus gram larutan 100% massa zat A % massa zat A ïī gr zat terlar ut ïŦ gr pelarut ï―
- 15. Contoh Soal âĒ Pada 50 gram asam cuka mengandung 10 gr asam asetat. Hitunglah kadar asam cuka tersebut? % Asam Cuka ï― ïī ï― 100 % 20% 10 gram 50 gram
- 16. Persentase Volume âĒ Persen volume menyatakan jumlah liter zat terlarut dalam seratus liter larutan 100% Volume zat X % Volume zat X ï― ïī Volume larutan
- 17. Contoh Soal âĒ Dalam label akohol yang dijual di toko obat tercantum kadar alkohol 70%. Berapa ml alkohol yang terdapat dalam 500 ml larutan alkohol tersebut?
- 18. Jawaban âĒ Misal volume alkohol murni = x ml 100% 70% x ml 500 ml % Alkohol murni persamaan dalam larutan alkohol : x 100 ï― 70 ïī 500 100 35000 350 ï― 35000 100 jadi volume alkohol dalam 500 ml larutan alkohol 70% adalah ï― 350 ï― ï― ï― ïī ï― x x
- 19. Bagian per juta (bpj) atau part per milion (ppm) âĒ Bpj atau ppm digunakan bila kadar suatu komponen dalam suatu campuran sangat sedikit. âĒ Bpj menyatakan 1 bagian zat dalam sejuta bagian campuran 6 10 massa/volume zat A bpj zat A ï― ïī massa/volume campuran
- 20. Contoh Soal âĒ Berapa bpj kadar CO2 di udara, jika udara bersih mengandung 0,00025% CO2? âĒ jawaban kadar CO 6 2 ï― ïī ï― 10 2,5 bpj 0,00025 100
- 21. Molaritas Larutan 1 Molar adalah larutan yang mengandung 1 mol zat terlarut dalam satu liter larutan. n V M ï― M = molaritas larutan n = mol V = volume
- 22. Pengenceran Definisi :Pengenceran adalah penambahan zat pelarut ke dalam suatu larutan Cara menghitung molaritasnya: Karena jumlah mol tetap n1=n2 maka: 1 1 2 2 M ïīV ï― M ïīV
- 23. Kemolaran larutan campuran Jika dua buah larutan/lebih yang zat terlarutnya sama, dengan volume dan konsentrasi yang berbeda, maka bila di campur akan diperoleh campuran dengan volume dan konsentrasi yang baru
- 24. Cara menghitung kemolaran larutan campuran Dan konsentrasi larutan campuran dapat di cari dengan ketentuan :âjumlah mol sebelum dan sesudah di campur adalah samaâ n1+n2=n3 V ïī M ïŦ V ïī M 1 1 2 2 3 V V 1 2 M ïŦ ï―
- 25. RUMUS EMPIRIS DAN RUMUS MOLEKUL âĒ Rumus empiris merupakan rumus perbandingan suatu senyawa âĒ Rumus molekul seyawa merupakan rumus kimia yang menggambarkan jumlah atom dan unsur penyusun senyawa
- 26. DATA YANG PERLUKAN DALAM MENENTUKAN RUMUS EMPIRIS DAN MOLEKUL âĒ Massa unsur; perbandingan massa unsur; atau presentase massa unsur yang menyusun senyawa âĒ Massa atom relatif; massa molekul relatif.
- 27. Contoh soal Suatu senyawa hidrokarbon mengandung 85.7% massa karbon dan sisanya massa hidrogen . Jika ditentukan Ar:H=1, C=12 dan molekul relatif senyawa hidrokarbon 56 tentukan rumus empiris dan rumus molekul senyawa tersebut
- 28. Jawaban 1. Cari massa dari hidrogen dan karbonnya % massa hidrogen = 100% - %massa karbon = 100% - 85.7% 2. Cari perbandingan molnya Perbandingan mol C : mol H % H : 14.3% : % C 85.7% 7.14 :14.3 1: 2 1 12 Ar H Ar C ï― ï― ï― ï―
- 29. 3. Dari perbandingan diperoleh rumus empiris senyawa=CH2 4. Hitung rumus molekul ï (Mr CH2)n=56 ï (12+2)n=56 ï n=4 Jadi rumus molekul dari unsur (CH2)4 atau C4H8
- 30. PERHITUNGAN KIMIA DALAM PERSAMAAN REAKSI Hub. Antara Jumlah Mol, Partikel, Massa, dan Volume Gas Dalam Persamaan Reaksi Pereaksi Pembatas
- 31. Hub. Antara Jumlah Mol, Partikel, Massa, dan Volume Gas Dalam Persamaan Reaksi Jumlah Partikel Jumlah Mol Massa (gram) Volume (liter) (x) 6,02 x 10 23 (:) 6,02 x 10 23 (x) 22,4 L (STP) PV = nRT 1 2 V 1 2 n n V ï― (:) 22,4 L (STP) (x) Ar/Mr (:) Ar/Mr
- 32. Pereaksi Pembatas âĒ Menuliskan persamaan reaksi lalu setarakan. âĒ Mengubah satuan zat yang diketahui menjadi satuan mol. âĒ Menentukan pereaksi pembatas. âĒ Menghitung jumlah mol yang ditanya. âĒ Mengubah satuan mol menjadi satuan lain yang diinginkan.
- 33. Contoh soal 1. Jika 8.1 gr logam aluminium direaksikan dengan larutan H2SO4, menghasilkan garam Al2(SO4)3 dan gas hidrogen (diketahui Ar; Al = 27, S = 32, danO=16) tentukan: a) Massa garam Al2(SO4)3 yang terbentuk b) Volume gas hidrogen pada keadaan STP
- 34. Jawaban âĒ Buat persamaan reaksinya: 2Al + 3H2SO4 ï Al2(SO4)3 + 3H2 âĒ Hitung mol Al 0,3 mol 8,1 gr gr n ï― ï― ï― Untuk menghitung massa Al2(SO4)3 âĒ Hitung mol Al2(SO4)3 dengan perbandingan koefisien n Al koefisien Al (SO ) jumlah mol Al (SO ) 2 4 3 2 4 3 ï― ïī koefisien Al 27 gr/mol Ar jumlah mol Al (SO )2 4 3 ï― ïī ï― 0,3 mol 0.15 mol 1 2
- 35. Jawaban Untuk menghitung volume STP gas hidrogen âĒ Hitung mol H2 jumlah mol H2 ï― ïī ï― 0,3 mol 0,45 mol 3 2 âĒ Hitung volume H2 2 2 STP Volume H STP ï― n H ïīV Volume H STP 0,45 mol 22,4 L mol 10,08 L -1 2 ï― ïī ï― Jadi volume H2= 10,08 L
- 36. 36 Pembatas Reaksi ï2 mol C2H5OH direaksikan dengan 2 mol O2. Berapa mol CO2 yang dihasilkan? Jawab: C2H5OH(l) + 3O2 (g) â 2CO2 (g) + 3H2O(l) 2/1 2/3 sisa > habis R: (1/3)x2 mol 2 mol(2/3)x2 mol = 0,67 mol = 1,33 mol Sisa = 2 â 0,67 = 1,33 mol















































































![Sifat koligatif larutan (media).pptx [autosaved]](https://cdn.slidesharecdn.com/ss_thumbnails/sifatkoligatiflarutanmedia-pptxautosaved-130608222836-phpapp01-thumbnail.jpg?width=560&fit=bounds)











































