1 of 30
Downloaded 121 times




























Recommended
Teori Orbital Molekul dan Ligan Field Theory PPT



Teori Orbital Molekul dan Ligan Field Theory PPTUniversity Of Jakarta
╠²
Teks tersebut membahas teori orbital molekul dan teori medan ligan dalam menjelaskan sifat-sifat senyawa kompleks. Teori orbital molekul mempertimbangkan interaksi elektrostatik dan kovalen antara atom pusat dan ligan, sehingga membentuk orbital molekul baru. Teori medan ligan melihat pengaruh energi orbital logam akibat interaksi dengan ligan. Kedua teori ini berperan penting dalam menjelaskan sifat warna, kemagnetanReaksi adisi aldehid dan keton



Reaksi adisi aldehid dan ketonDM12345
╠²
1. Reaksi adisi aldehid dan keton meliputi reaksi dengan air, alkohol, hidrogen sianida, reagen Grignard, dan reduksi hidrogen.
2. Faktor yang mempengaruhi reaktivitas antara lain muatan positif karbon karbonil dan faktor sterik. Semakin reaktif senyawa, produk yang dihasilkan semakin stabil.
3. Reaksi adisi dapat menghasilkan berbagai produk seperti diol, asetal, ketal, hidroksinitril, alkohTeori orbital molekul



Teori orbital molekulHarewood Jr.
╠²
Teori orbital molekul menjelaskan pembentukan ikatan dalam senyawa kompleks melalui kombinasi orbital atom logam dan ligan, membentuk orbital molekul bonding dan antibonding yang dapat memprediksi sifat senyawa kompleks seperti bentuk geometri dan warna berdasarkan konfigurasi elektronnya.laporan kimia fisik - Kelarutan sebagai fungsi temperatur



laporan kimia fisik - Kelarutan sebagai fungsi temperaturqlp
╠²
laporan kimia fisik - Kelarutan sebagai fungsi temperaturSimetry



SimetrySirod Judin
╠²
Dokumen tersebut membahas tentang simetri molekular, termasuk definisi simetri, unsur-unsur simetri seperti sumbu rotasi dan bidang cermin, serta penggolongan kelompok simetri molekul menggunakan aliran kerja diagram.ikatan kimia



ikatan kimiaDede Suhendra
╠²
Ikatan kimia terjadi karena gaya tarik antaratom yang membentuk senyawa yang lebih kompleks. Terdapat dua jenis ikatan utama, yaitu ikatan ionik dan kovalen. Ikatan ionik terjadi antara ion positif dan negatif, sedangkan ikatan kovalen melibatkan pemakaian elektron bersama antaratom. Teori ikatan valensi menjelaskan pembentukan ikatan melalui overlapping orbital antaratom.Laporan Praktikum Kimia Anorganik II - Kimia Tembaga



Laporan Praktikum Kimia Anorganik II - Kimia TembagaAndrio Suwuh
╠²
Dokumen tersebut membahas tentang percobaan pembuatan tembaga (I) oksida dari larutan tembaga (II) sulfat dengan menggunakan campuran natrium hidroksida dan kalium tartrat. Ketika glukosa ditambahkan ke dalam larutan biru yang dihasilkan, akan terbentuk endapan merah jingga yaitu tembaga (I) oksida.Adisi Elektrofilik



Adisi Elektrofilikelfisusanti
╠²
Dokumen tersebut membahas tentang reaksi adisi elektrofilik pada ikatan rangkap karbon-karbon, termasuk mekanisme, contoh reaksi, dan aturan Markovnikoff.Warna & kemagnetan senyawa kompleks 2017 1



Warna & kemagnetan senyawa kompleks 2017 1AyumaGanbatte AlKaoru
╠²
The document discusses electronic spectra and color of transition metal complexes. It explains that the color of complexes is due to electronic transitions between split d-orbital energy levels of the metal ion. Crystal field theory is used to describe the splitting of d-orbitals in an octahedral ligand field, which determines the color. Complexes with strong field ligands have large splitting and absorb at higher energies, appearing more intensely colored.TOM (Teori Orbital Molekul)



TOM (Teori Orbital Molekul)Farikha Uly
╠²
Dokumen ini memberikan penjelasan tentang Teori Orbital Molekul (TOM) yang menjelaskan pembentukan ikatan kimia antara atom-atom dalam membentuk molekul. TOM menjelaskan bagaimana orbital-orbital atom tumpang tindih dan membentuk orbital-orbital molekul ikatan dan antiikatan, serta urutan pengisian elektron pada orbital-orbital tersebut. Contoh penerapan TOM pada beberapa molekul diatomik seperti H2, O2, danIkatan kimia, ikatan ion, dan ikatan kovalen



Ikatan kimia, ikatan ion, dan ikatan kovalenFitriHastuti2
╠²
ikatan kimia antara lain ikatan ion dan ikatan kovalenANALISIS INSTRUMEN SOAL ASAM BASA



ANALISIS INSTRUMEN SOAL ASAM BASALinda Rosita
╠²
1. Dokumen tersebut merupakan analisis instrumen soal untuk mata kuliah evaluasi dan penilaian hasil belajar kimia.
2. Terdapat kisi-kisi soal pilihan ganda dan essay yang mencakup lima indikator dan lima kompetensi dasar.
3. Juga terdapat pedoman penilaian sikap peserta didik dan daftar cek penilaian diri.Isomer e dan z



Isomer e dan zMuhammad Luthfan
╠²
Isomer E-Z menggunakan aturan prioritas untuk menentukan posisi relatif gugus-gugus terikat pada atom karbon ikatan rangkap. Jika gugus-gugus berprioritas tinggi berada di sisi yang sama, disebut Z. Jika berlawanan, disebut E. Aturan prioritas didasarkan pada nomor atom dan ikatan berikutnya. Contohnya adalah 2-kloro-2-butena.Aldehid



Aldehidkimia12ipa1213
╠²
Aldehid adalah senyawa organik dengan gugus fungsi -CHO. Aldehid dapat dihasilkan dari oksidasi alkohol primer dan dapat teroksidasi menjadi asam karboksilat. Aldehid dapat diidentifikasi melalui reaksi dengan larutan Fehling dan Tollens yang menghasilkan endapan tembaga(II) oksida dan perak.Reaksi Reaksi Kimia



Reaksi Reaksi Kimianinisbanuwati96
╠²
Dokumen ini membahas beberapa jenis reaksi kimia seperti reaksi penggabungan, penguraian, pendesakan, metatesis, pembakaran, dan netralisasi. Reaksi penggabungan terjadi ketika dua zat bergabung membentuk zat baru, sementara reaksi penguraian terjadi pada suhu tinggi dimana senyawa tunggal terurai menjadi dua zat baru. Reaksi ionik melibatkan pertukaran ion antar zat dalam larPengertian gas ideal dan gas nyata



Pengertian gas ideal dan gas nyataAris Wibowo
╠²
Dokumen tersebut membahas tentang gas ideal dan gas nyata. Gas ideal adalah gas hipotetis yang benar-benar mengikuti hukum gas seperti hukum Boyle, Charles, dan Gay-Lussac pada semua kondisi, sedangkan gas nyata hanya mengikuti hukum-hukum tersebut pada tekanan dan suhu rendah karena adanya interaksi antar molekul. Dokumen juga menjelaskan perbedaan antara gas ideal dan gas nyata serta hukum-hukum terkAldehida dan Keton



Aldehida dan KetonNadila Embun Sari
╠²
Berdasarkan hasil reaksi identifikasi yang diberikan, senyawa dengan rumus C3H6O tersebut adalah aldehida.
1. Dengan pereaksi Fehling menghasilkan endapan merah bata, menunjukkan adanya gugus aldehida.
2. Oksidasi menghasilkan senyawa yang dapat memerahkan lakmus biru, yaitu asam karboksilat, menunjukkan bahwa senyawa awal adalah aldehida.
Oleh karena itu, gugusTeori orbital molekul kompleks



Teori orbital molekul kompleksElis Primalis
╠²
Dokumen tersebut membahas tentang teori orbital molekul kompleks logam transisi. Teori ini menjelaskan pembentukan orbital molekul dari kombinasi orbital atom logam dan ligan dalam kompleks, di mana terbentuk orbital ikatan, non-ikatan, dan anti-ikatan. Orbital-orbital tersebut mempengaruhi sifat dan stabilitas kompleks.More Related Content
What's hot (20)
Simetry



SimetrySirod Judin
╠²
Dokumen tersebut membahas tentang simetri molekular, termasuk definisi simetri, unsur-unsur simetri seperti sumbu rotasi dan bidang cermin, serta penggolongan kelompok simetri molekul menggunakan aliran kerja diagram.ikatan kimia



ikatan kimiaDede Suhendra
╠²
Ikatan kimia terjadi karena gaya tarik antaratom yang membentuk senyawa yang lebih kompleks. Terdapat dua jenis ikatan utama, yaitu ikatan ionik dan kovalen. Ikatan ionik terjadi antara ion positif dan negatif, sedangkan ikatan kovalen melibatkan pemakaian elektron bersama antaratom. Teori ikatan valensi menjelaskan pembentukan ikatan melalui overlapping orbital antaratom.Laporan Praktikum Kimia Anorganik II - Kimia Tembaga



Laporan Praktikum Kimia Anorganik II - Kimia TembagaAndrio Suwuh
╠²
Dokumen tersebut membahas tentang percobaan pembuatan tembaga (I) oksida dari larutan tembaga (II) sulfat dengan menggunakan campuran natrium hidroksida dan kalium tartrat. Ketika glukosa ditambahkan ke dalam larutan biru yang dihasilkan, akan terbentuk endapan merah jingga yaitu tembaga (I) oksida.Adisi Elektrofilik



Adisi Elektrofilikelfisusanti
╠²
Dokumen tersebut membahas tentang reaksi adisi elektrofilik pada ikatan rangkap karbon-karbon, termasuk mekanisme, contoh reaksi, dan aturan Markovnikoff.Warna & kemagnetan senyawa kompleks 2017 1



Warna & kemagnetan senyawa kompleks 2017 1AyumaGanbatte AlKaoru
╠²
The document discusses electronic spectra and color of transition metal complexes. It explains that the color of complexes is due to electronic transitions between split d-orbital energy levels of the metal ion. Crystal field theory is used to describe the splitting of d-orbitals in an octahedral ligand field, which determines the color. Complexes with strong field ligands have large splitting and absorb at higher energies, appearing more intensely colored.TOM (Teori Orbital Molekul)



TOM (Teori Orbital Molekul)Farikha Uly
╠²
Dokumen ini memberikan penjelasan tentang Teori Orbital Molekul (TOM) yang menjelaskan pembentukan ikatan kimia antara atom-atom dalam membentuk molekul. TOM menjelaskan bagaimana orbital-orbital atom tumpang tindih dan membentuk orbital-orbital molekul ikatan dan antiikatan, serta urutan pengisian elektron pada orbital-orbital tersebut. Contoh penerapan TOM pada beberapa molekul diatomik seperti H2, O2, danIkatan kimia, ikatan ion, dan ikatan kovalen



Ikatan kimia, ikatan ion, dan ikatan kovalenFitriHastuti2
╠²
ikatan kimia antara lain ikatan ion dan ikatan kovalenANALISIS INSTRUMEN SOAL ASAM BASA



ANALISIS INSTRUMEN SOAL ASAM BASALinda Rosita
╠²
1. Dokumen tersebut merupakan analisis instrumen soal untuk mata kuliah evaluasi dan penilaian hasil belajar kimia.
2. Terdapat kisi-kisi soal pilihan ganda dan essay yang mencakup lima indikator dan lima kompetensi dasar.
3. Juga terdapat pedoman penilaian sikap peserta didik dan daftar cek penilaian diri.Isomer e dan z



Isomer e dan zMuhammad Luthfan
╠²
Isomer E-Z menggunakan aturan prioritas untuk menentukan posisi relatif gugus-gugus terikat pada atom karbon ikatan rangkap. Jika gugus-gugus berprioritas tinggi berada di sisi yang sama, disebut Z. Jika berlawanan, disebut E. Aturan prioritas didasarkan pada nomor atom dan ikatan berikutnya. Contohnya adalah 2-kloro-2-butena.Aldehid



Aldehidkimia12ipa1213
╠²
Aldehid adalah senyawa organik dengan gugus fungsi -CHO. Aldehid dapat dihasilkan dari oksidasi alkohol primer dan dapat teroksidasi menjadi asam karboksilat. Aldehid dapat diidentifikasi melalui reaksi dengan larutan Fehling dan Tollens yang menghasilkan endapan tembaga(II) oksida dan perak.Reaksi Reaksi Kimia



Reaksi Reaksi Kimianinisbanuwati96
╠²
Dokumen ini membahas beberapa jenis reaksi kimia seperti reaksi penggabungan, penguraian, pendesakan, metatesis, pembakaran, dan netralisasi. Reaksi penggabungan terjadi ketika dua zat bergabung membentuk zat baru, sementara reaksi penguraian terjadi pada suhu tinggi dimana senyawa tunggal terurai menjadi dua zat baru. Reaksi ionik melibatkan pertukaran ion antar zat dalam larPengertian gas ideal dan gas nyata



Pengertian gas ideal dan gas nyataAris Wibowo
╠²
Dokumen tersebut membahas tentang gas ideal dan gas nyata. Gas ideal adalah gas hipotetis yang benar-benar mengikuti hukum gas seperti hukum Boyle, Charles, dan Gay-Lussac pada semua kondisi, sedangkan gas nyata hanya mengikuti hukum-hukum tersebut pada tekanan dan suhu rendah karena adanya interaksi antar molekul. Dokumen juga menjelaskan perbedaan antara gas ideal dan gas nyata serta hukum-hukum terkAldehida dan Keton



Aldehida dan KetonNadila Embun Sari
╠²
Berdasarkan hasil reaksi identifikasi yang diberikan, senyawa dengan rumus C3H6O tersebut adalah aldehida.
1. Dengan pereaksi Fehling menghasilkan endapan merah bata, menunjukkan adanya gugus aldehida.
2. Oksidasi menghasilkan senyawa yang dapat memerahkan lakmus biru, yaitu asam karboksilat, menunjukkan bahwa senyawa awal adalah aldehida.
Oleh karena itu, gugusViewers also liked (11)
Teori orbital molekul kompleks



Teori orbital molekul kompleksElis Primalis
╠²
Dokumen tersebut membahas tentang teori orbital molekul kompleks logam transisi. Teori ini menjelaskan pembentukan orbital molekul dari kombinasi orbital atom logam dan ligan dalam kompleks, di mana terbentuk orbital ikatan, non-ikatan, dan anti-ikatan. Orbital-orbital tersebut mempengaruhi sifat dan stabilitas kompleks.Pembentukan ikatan teori-orbital-hibridisasi



Pembentukan ikatan teori-orbital-hibridisasiAli Husni
╠²
Orbital atom dapat saling tumpang tindih untuk membentuk ikatan kimia. Ikatan sigma terbentuk melalui tumpang tindih orbital s dan p. Hibridisasi terjadi ketika orbital-orbital campur untuk membentuk orbital baru yang memungkinkan pembentukan ikatan kovalen. Contohnya adalah orbital sp3 pada karbon yang memungkinkan pembentukan 4 ikatan.Rumus struktur senyawa kompleks



Rumus struktur senyawa kompleksNakashima Taiki
╠²
Dokumen tersebut membahas beberapa rumus molekul kompleks koordinasi yang terdiri dari ligan amonia, sianida, dan klorida dengan logam perak, seng, nikel, dan platina sebagai atom pusatnya. Untuk setiap rumus molekul, diberikan informasi mengenai basa Lewis atau ligan, asam Lewis, atom donor, dan bilangan koordinasi.Makalah ikatan kimia dan struktur molekul



Makalah ikatan kimia dan struktur molekulAngga Oktyashari
╠²
Makalah ini membahas tentang ikatan kimia dan struktur molekul. Topik yang dibahas meliputi pemutusan ikatan, molekul polar dan nonpolar, gaya tarik antar molekul, ikatan sigma dan pi, orbital hibrida karbon dan nitrogen, serta resonansi.Similar to Teori orbital molekul (20)
Struktur atom,sistem periodik unsur dan ikatan kimia XI IPA



Struktur atom,sistem periodik unsur dan ikatan kimia XI IPADian Ningrum
╠²
Dokumen tersebut membahas tentang struktur atom, sistem periodik unsur, ikatan kimia, dan konfigurasi elektron berdasarkan konsep bilangan kuantum seperti aturan Aufbau, aturan Pauli, dan aturan Hund. Secara khusus membahas tentang teori atom mekanika kuantum, diagram orbital, letak unsur dalam tabel periodik, bentuk geometri molekul, teori ikatan seperti VSEPR dan hibridisasi, serta jenis ikatan seperti ion, kovalen, hidIkatan kimia dan struktur molekul



Ikatan kimia dan struktur molekulAngga Oktyashari
╠²
Dokumen tersebut memberikan ringkasan tentang beberapa konsep dasar kimia organik seperti pemutusan ikatan, ikatan polar dan non-polar, momen ikatan dan dipol, gaya tarik antar molekul, ikatan sigma dan pi, hibridisasi orbital karbon, nitrogen dan oksigen, serta konsep resonansi dan pergeseran elektron.2. struktur atom dan molekul



2. struktur atom dan molekulSekolah Tinggi Farmasi Indonesia
╠²
Materi ke 1 untuk mata kuliah Kimia Fisika / Farmasi Fisika
keterangan selengkapnya silahkan kunjungi http://www.catatankimia.comLamtiur d sihotang (8136142014)



Lamtiur d sihotang (8136142014)Lamtiur Sihotang
╠²
Dokumen tersebut membahas berbagai jenis ikatan kimia seperti ikatan ion, ikatan kovalen, teori orbital molekul, teori ikatan valensi. Dijelaskan pembentukan ikatan antara ion logam dan nonlogam melalui gaya elektrostatik (ikatan ion), pembentukan ikatan karena pemakaian pasangan elektron secara bersama (ikatan kovalen), serta teori orbital molekul dan teori ikatan valensi untuk menjelaskan sifat ikatan kim2 ikatan-kimia1



2 ikatan-kimia1blvck
╠²
Terdapat berbagai jenis ikatan kimia yang terbentuk untuk mencapai kestabilan atom. Ikatan ion terbentuk melalui proses pelepasan dan penarikan elektron antara logam dan nonlogam, sementara ikatan kovalen terjadi karena penggunaan bersama elektron oleh dua atom atau lebih. Ikatan logam, van der Waals, dan hidrogen juga terbentuk melalui interaksi antar atom atau molekul.struktur atom, sistem periodik, dan ikatan kimia



struktur atom, sistem periodik, dan ikatan kimiamfebri26
╠²
struktur atom, sistem periodik, dan ikatan kimia #kimiaBab 1 struktur atom, tabel periodik, dan ikatan kimia 



Bab 1 struktur atom, tabel periodik, dan ikatan kimia wafiqasfari
╠²
Dokumen tersebut membahas tentang struktur atom, sistem periodik, dan ikatan kimia. Terdapat penjelasan mengenai teori atom Bohr dan mekanika kuantum untuk menentukan konfigurasi elektron dan letak unsur dalam tabel periodik. Juga dibahas mengenai hibridisasi untuk meramalkan bentuk molekul, serta interaksi antarmolekul seperti gaya van der Waals dan ikatan hidrogen.4. IKATAN KIMIA Tahun 2021.ppt



4. IKATAN KIMIA Tahun 2021.pptDewiMarhelly3
╠²
ikatan kimia adalah ikatan yang erjadi antara senyawa2 kimia yang terdiri dair ikatan ion dan ikatan kovlen, ikatan kovalen terdiri dari tunggal, rangkap 2, rangkap 34. IKATAN KIMIA Tahun 2021.ppt



4. IKATAN KIMIA Tahun 2021.pptangga678964
╠²
Ada tiga jenis ikatan kimia antar atom, yaitu ikatan ion, ikatan kovalen, dan ikatan logam. Ikatan ion terjadi karena adanya gaya elektrostatik antara ion-ion bermuatan, sedangkan ikatan kovalen terjadi karena penggunaan bersama elektron oleh dua atom atau lebih. Ikatan logam dihasilkan dari interaksi antara inti atom dan elektron-elektron yang bergerak bebas di antaranya.4. IKATAN KIMIA Tahun 2021.ppt



4. IKATAN KIMIA Tahun 2021.pptRizaUmmami3
╠²
Ada tiga jenis ikatan kimia antar atom, yaitu ikatan ion, ikatan kovalen, dan ikatan logam. Ikatan ion terjadi karena adanya gaya elektrostatik antara ion-ion bermuatan, sedangkan ikatan kovalen terjadi karena penggunaan bersama elektron oleh dua atom atau lebih. Ikatan logam dihasilkan dari interaksi antara inti atom dan elektron-elektron yang bergerak bebas di antaranya.Recently uploaded (20)
Scenario Planning Bonus Demografi 2045 Menuju Satu Abad Indonesia Emas



Scenario Planning Bonus Demografi 2045 Menuju Satu Abad Indonesia EmasDadang Solihin
╠²
Sejalan dengan visi Indonesia Emas 2045, yaitu Negara Nusantara Berdaulat, Maju, dan Berkelanjutan, kajian ini menekankan pentingnya membangun Indonesia yang kuat, mandiri, dan berkelanjutan di tahun 2045. Dalam konteks itu, optimalisasi angkatan kerja dan pemanfaatan bonus demografi menjadi faktor krusial untuk mencapai visi tersebut.5. LKPD Polimer dan Mokromolekul Kelas XII



5. LKPD Polimer dan Mokromolekul Kelas XIIDonoSepauk
╠²
LKPD merupakan lembar kerja siswa pada materi polimerPRAKTIK PEMBUATAN RPP DEEP LEARNING fix.pptx



PRAKTIK PEMBUATAN RPP DEEP LEARNING fix.pptxNurulIlyas3
╠²
Materi PRAKTIK PEMBUATAN RPP DEEP LEARNING fix.pptxMateri Seminar Agar Ramadhan Tetap Produktif 2025.pdf



Materi Seminar Agar Ramadhan Tetap Produktif 2025.pdfNamin AB Ibnu Solihin
╠²
Materi Seminar Agar Ramadhan Tetap Produktif 2025 - Disampaikan Oleh Namin AB Ibnu SolihinSTRUKTUR GEOLOGI REGIONAL PULAU JAWA.pdf



STRUKTUR GEOLOGI REGIONAL PULAU JAWA.pdfArio Arief iswandhani
╠²
STRUKTUR GEOLOGI REGIONAL PULAU JAWA.pdfBAB 1 Kode Etik & Profesionalisme Guru PAK pjj.pptx



BAB 1 Kode Etik & Profesionalisme Guru PAK pjj.pptxAGUNGDJUMARI
╠²
KODE ETIK DAN PROFESIONALISME GURU PENDIDIKAN AGAMA KRISTENMasukan untuk Peta Jalan Strategis Keangkasaan Indonesia



Masukan untuk Peta Jalan Strategis Keangkasaan IndonesiaDadang Solihin
╠²
Tujuan penyusunan naskah masukan untuk peta jalan strategis keangkasaan Indonesia ini adalah untuk meningkatkan kedaulatan dan pemanfaatan wilayah angkasa Indonesia dalam rangka memperkuat Ketahanan Nasional dan Visi Indonesia Emas 2045.MATERI KE 3 BACAAN MAD (PANJANG) TAHSIN 2025



MATERI KE 3 BACAAN MAD (PANJANG) TAHSIN 2025BangZiel
╠²
Materi ini membahas hukum bacaan Mad (panjang) dalam ilmu tajwid, yang terjadi ketika ada huruf mad (ž¦, ┘ł, ┘Ŗ) dalam bacaan Al-Qur'an. Pembahasan mencakup jenis-jenis mad, hukum bacaan, serta panjangnya dalam harakat.BERBICARA FORMAL, NONFORMAL, DAN PRESENTASI.pptx



BERBICARA FORMAL, NONFORMAL, DAN PRESENTASI.pptxputuariutama
╠²
BERBICARA FORMAL, NONFORMAL, DAN PRESENTASIPengembangan Entrepreneur Vokasi Melalui PERFECT SMK-Society 50 .pptx



Pengembangan Entrepreneur Vokasi Melalui PERFECT SMK-Society 50 .pptxFajar Baskoro
╠²
Pengembangan Entrepreneur Vokasi Melalui PERFECT SMK-Society 50 .pptxMuqaddimah ANGGARAN DASAR Muhammadiyah .pptx



Muqaddimah ANGGARAN DASAR Muhammadiyah .pptxsuwaibahkapa2
╠²
MUQODDIMAH
ž©ž│┘ģ ž¦┘ä┘ä┘ć ž¦┘äž▒žŁ┘ģ┘å ž¦┘äž▒žŁ┘Ŗ┘ģ
(5) ž¦┘䞣┘ģž»┘ä┘ä┘ć ž▒ž©┘æ ž¦┘äž╣ž¦┘ä┘ģ┘Ŗ┘å (1) ž¦┘äž▒žŁ┘ģ┘å ž¦┘äž▒žŁ┘Ŗ┘ģ (2) ┘ģ┘ä┘ā ┘Ŗ┘ł┘ģ ž¦┘äž»┘Ŗ┘å (3) žź┘Ŗž¦┘ā ┘åž╣ž©ž» ┘łžź┘Ŗž¦┘ā ┘åž│ž¬ž╣┘Ŗ┘å (4) ž¦┘ćž»┘垦 ž¦┘䞥ž▒ž¦žĘ ž¦┘ä┘ģž│ž¬┘é┘Ŗ┘ģ
(6) žĄž▒ž¦žĘ ž¦┘äž░┘Ŗ┘å žŻ┘åž╣┘ģž¬ ž╣┘ä┘Ŗ┘ć┘ģ ž║┘Ŗž▒ ž¦┘ä┘ģž║žČ┘łž© ž╣┘ä┘Ŗ┘ć┘ģ ┘ł┘䞦 ž¦┘äžČžó┘ä┘æ┘Ŗ┘å
ŌĆ£Dengan nama Allah Yang Maha Pemurah dan Penyayang. Segala puji bagi Allah yang mengasuh semua alam, yang Maha Pemurah dan Maha Penyayang, Yang memegang pengadilan pada hari kemudian. Hanya kepada Engkau hamba menyembah, dan hanya kepada Engkau, kami mohon pertolongan. Berilah petunjuk kepada hamba akan jalan yang lempang, jalan orang-orang yang telah Engkau beri kenikmatan, yang tidak dimurkai dan tidak tersesat.ŌĆØ (QS Al-Fatihah 1-6)
ž▒žČ┘Ŗž¬ ž©ž¦┘ä┘ä┘ć ž▒ž©┘枦 ┘łž©ž¦┘äžźž│┘䞦┘ģ ž»┘Ŗ┘垦┘ŗ ┘łž©┘ģžŁ┘ģž» žĄ┘ä┘ē ž¦┘ä┘ä┘ć ž╣┘ä┘Ŗ┘ć ┘łž│┘ä┘æ┘ģ ┘åž©┘Ŗ┘枦 ┘łž▒ž│┘ł┘䞦┘ŗ
ŌĆ£Saya ridla: Ber-Tuhan kepada ALLAH, ber-Agama kepada ISLAM dan ber-Nabi kepada MUHAMMAD RASULULLAH Shalallahu ŌĆśalaihi wassalamŌĆØ.
AMMA BADŌĆÖU, bahwa sesungguhnya ke-Tuhanan itu adalah hak Allah semata-mata. Ber-Tuhan dan berŌĆÖibadah serta tunduk dan thaŌĆÖat kepada Allah adalah satu-satunya ketentuan yang wajib atas tiap-tiap makhluk, terutama manusia.
Hidup bermasyarakat itu adalah sunnah (hukum qudrat iradat) Allah atas kehidupan manusia di dunia ini.
Masyarakat yang sejahtera, aman damai, makmur dan bahagia hanyalah dapat diwujudkan di atas keadilan, kejujuran, persaudaraan dan gotong-royong, bertolong-tolongan dengan bersendikan hukum Allah yang sebenar-benarnya, lepas dari pengaruh syaitan dan hawa nafsu.
Agama Allah yang dibawa dan diajarkan oleh sekalian Nabi yang bijaksana dan berjiwa suci, adalah satu-satunya pokok hukum dalam masyarakat yang utama dan sebaik-baiknya.
Menjunjung tinggi hukum Allah lebih daripada hukum yang manapun juga, adalah kewajiban mutlak bagi tiap-tiap orang yang mengaku ber-Tuhan kepada Allah.
Agama Islam adalah Agama Allah yang dibawa oleh sekalian Nabi,sejak Nabi Adam sampai Nabi Muhammad saw, dan diajarkan kepada umatnya masing-masing untuk mendapatkan hidup bahagia Dunia dan Akhirat.
Syahdan, untuk menciptakan masyarakat yang bahagia dan sentausa sebagai yang tersebut di atas itu, tiap-tiap orang, terutama umat Islam, umat yang percaya akan Allah dan Hari Kemudian, wajiblah mengikuti jejak sekalian Nabi yang suci: beribadah kepada Allah dan berusaha segiat-giatnya mengumpulkan segala kekuatan dan menggunakannya untuk menjelmakan masyarakat itu di Dunia ini, dengan niat yang murni-tulus dan ikhlas karena Allah semata-mata dan hanya mengharapkan karunia Allah dan ridha-Nya belaka, serta mempunyai rasa tanggung jawab di hadirat Allah atas segala perbuatannya, lagi pula harus sabar dan tawakal bertabah hati menghadapi segala kesukaran atau kesulitan yang menimpa dirinya, atau rintangan yang menghalangi pekerjaannya, dengan penuh pengharapan perlindungan dan pertolongan Allah Yang Maha Kuasa.
Untuk melaksanakan terwujudnya masyarakat yang demikian itu, maka dengan berkat dan rahmat Allah didorong oleh firman Allah dalam Al-QurŌĆÖan:
┘ł┘Ä┘ä█Īž¬┘Ä┘ā┘Å┘å ┘ģ┘É┘æ┘å┘ā┘Å┘ģ█Ī žŻ┘Å┘ģ┘Ä┘æž®┘ī█¼ ┘Ŗ┘Äž»█Īž╣┘Å┘ł┘å┘Ä žź┘É┘ä┘Ä┘ē ┘▒┘ä█Īž«┘Ä┘Ŗ█Īž▒┘É ┘ł┘Ä┘Ŗ┘ÄžŻ█Ī┘ģ┘Åž▒┘Å┘ł┘å┘Ä ž©┘É┘▒┘ä█Ī┘ģ┘Äž╣█Īž▒┘Å┘ł┘ü┘É ┘łTeori orbital molekul
- 1. Teori Orbital Molekul Group 1 : Muhammad Hijir Algazali Ikra Febriyanti Agusman Hasrobin Dedi Setiawan Destri Muliastri Herlan
- 2. Teori Orbital Molekul Pendahuluan Orbital Atomik Gambar Orbital Molekul Orbital Molekular Teori Orbital Molekul Gambar Orbital Molekular Tipe Orbital Molekular Ikatan Sigma Ikatan Pi Orbital Antiikat Orbital Hibrida Ikatan-ikatan Kimia & muatan formal Peta Konsep
- 3. PENDAHULUAN Orbit Teori Niels Bohr Posisi tepat dari suatu partikel Orbital Teori Kuantum (asas Haisenberg) Tempat kebolehjadian menemukan elektron Didasarkan pada persamaan matematik schrodinger
- 4. Orbital Atomik Dualisme Partikel (Louis De Broglie) elektron sebagai partikel elektron sebagai gelombang Persamaan gelombang (Erwin Schrodinger) Bilangan-bilangan kuantum Kuantum utama Kuantum azimut Kuantum magnetik 0,1,2,3ŌĆ”.n-1 (s,p,d,f,ŌĆ”)
- 5. Gambar Orbital Atomik Orbital S Orbital p Orbital d Orbital f
- 6. Gabungan 2 atom Dipengaruhi dua inti atom Teori Orbital Molekul Orbital Molekul Jumlahnya sama dengan jumlah orbital atomik (yang bergabung)
- 7. Tipe Orbital Molekular Orbital molekular Orbital Ikat Ikatan Sigma Orbital antiikat Ikatan Pi
- 8. Gambar Orbital Molekul Antiikat Ikat
- 9. Ikatan Sigma 1 Orbital ikat membentuk ikatan sigma ŌĆó Kedua fungsi gelombang orbital bergabung secara konstruktif 2 ŌĆó Membentuk orbital ikat 3 ŌĆó Elektron ikat terkonsentrasi disepanjang garis penghubung inti kedua atom
- 10. 1 Orbital ikat membentuk ikatan pi IKATAN PI ŌĆó Terbentuk karena overlap 2 orbital p dengan orientasi tegak lurus garis penghubung kedua inti 2 ŌĆó Densitas elektron ikatannya terpusat di atas dan di bawah garis penghubung kedua inti 3 ŌĆó Sifat overlap paralel bukan linier seperti pada ikatan sigma
- 11. Orbital Antiikat Bagian orbital atomik yang overlap berlawanan fase Fungsi gelombang orbital saling meniadakan Terbentuk orbital molekular antiikat
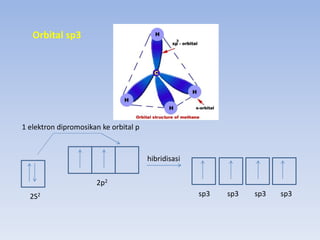
- 12. ORBITAL HIBRIDA 2 atau lebih orbital atomik Bergabung membentuk orbital baru Orbital Hibrida Sp3 = 1 orbital s dan 3 orbital p Sp2 = 1 orbital s dan 2 orbital p Sp = 1 orbital s dan 1 orbital p
- 13. Orbital sp3 1 elektron dipromosikan ke orbital p 2p2 hibridisasi 2S2 sp3 sp3 sp3 sp3
- 14. Pembentukan Ikatan ŌĆó Ikatan terbentuk melalui overlap antara orbital s dari atom H dan orbital hibrid sp3 dari atom C C-H ŌĆó Ikatan terbentuk melalui overlap orbital sp3 dari masing-masing atom C (hidrokarbon selain metana) C-C
- 15. 2s sp2 sp2 sp2 p hibridisasi 2p3 Orbital sp2
- 16. ŌĆó Ikatan terbentuk melalui overlap antara orbital s dari atom H dan orbital sp2 Pembentukan Ikatan C-H dari atom C ŌĆó Ikatan terbentuk melalui orbital p dari masing-masing atom C (ikatan pi) dan orbital sp2 masing-masing atom C (ikatan sigma) C=C
- 17. Orbital sp 2s 2p3 sp sp p p hibridisasi
- 18. Pembentukan Ikatan ŌĆó Ikatan terbentuk melalui overlap orbital s dari atom H dan orbital sp dari atom c C-H ŌĆó Ikatan terbentuk oleh overlap 2 pasang orbital p dari masing-masing atom c (2 ikatan pi) dan overlap orbital sp dari masing-masing atom c (1 ikatan sigma). CŌēĪC
- 19. IKATAN-IKATAN KIMIA 1. Ikatan kovalen 2. Ikatan Ion 3. Ikatan Hidrogen 4. Ikatan Logam 5. Ikatan Van derWaals
- 20. 1. Ikatan Kovalen Penggunaan pasangan elektron ikatan secara bersama Terjadi antara kedua atom yang membutuhkan elektron Terbagi atas kovalen polar dan nonpolar ŌĆó Ikatan kovalen polar jika elektronegativitas kedua atom yang bergabung tidak sama ŌĆó Ikatan kovalen nonpolar jika elektronegativitas kedua atom yang berikatan sama besarnya
- 21. Ikatan-ikatan kovalen yang tergolong nonpolar Untuk ikatan kovalen polar contohnya pada ikatan hidrogen
- 22. 2. Ikatan Ionik
- 23. Natrium membentuk Ion positif (kation) Klor membentuk ion negatif (anion) Kisi kristal NaCl Disatukan oleh Gaya elektrostatis
- 24. 3. Ikatan Hidrogen Ikatan antara atom hidrogen dan atom-atom sangat elektronegatif Umumnya atom nitrogen (N), oksigen (O), dan florin (F) Tergolong ikatan kovalen polar, bahkan ŌĆ£sangat polarŌĆØ
- 25. Ikatan hidrogen dapat saling berinteraksi Tarikan antar molekul menjadi lebih kuat Meningkatkan titik didih molekul
- 26. 4. Ikatan logam Atom-atom logam berada dalam suatu kemas rapat Elektron-elektron valensi logam bebas bereksplorasi dalam kisi Elektron-elektron valensi membentuk apa yang disebut dengan awan elektron Awan elektron (-) mengikat kemas kation logam (+) akibat gaya elektrostatis
- 27. Elektron valensi bebas bergerak dalam struktur logam 1s2 2s2 2p Orbital molekular logam Be4 Elektron ikat Pita valensi Pita konduksi
- 28. 5. Ikatan Van derWaals Molekul-molekul mengalami momen dipol sementara Molekul-molekul dengan adanya momen dipol akan saling berinteraksi Menghasilkan ikatan antar molekul yang relatif lemah
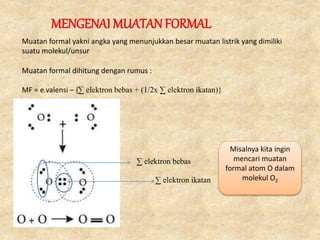
- 29. MENGENAI MUATAN FORMAL Muatan formal yakni angka yang menunjukkan besar muatan listrik yang dimiliki suatu molekul/unsur Muatan formal dihitung dengan rumus : MF = e.valensi ŌĆō {╬Ż elektron bebas + (1/2x ╬Ż elektron ikatan)} ╬Ż elektron bebas ╬Ż elektron ikatan Misalnya kita ingin mencari muatan formal atom O dalam molekul O2





































