1 of 13
Download to read offline







Recommended
Tata nama-senyawa-karbon



Tata nama-senyawa-karbonNanda Reda
Ã˝
Senyawa karbon dapat dibedakan menjadi senyawa karbon dan senyawa hidrokarbon. Senyawa karbon mengandung unsur selain karbon dan hidrogen, sementara senyawa hidrokarbon hanya mengandung karbon dan hidrogen. Dokumen ini membahas perbedaan jenis senyawa karbon seperti alkohol, eter, aldehida, keton, asam karboksilat, dan ester beserta penamaannya.22kimia organik-1



22kimia organik-1Habibur Rohman
Ã˝
Kimia organik mempelajari senyawa karbon dan turunannya. Dokumen ini membahas tentang sejarah, klasifikasi, dan contoh senyawa organik seperti alkana, sikloalkana, alkena, alkuna, aromatik, dan turunan benzena. Struktur dan sifat senyawa organik ditentukan oleh ikatan kimia antara atom-atom karbon dan hidrogen serta gugus-gugus fungsional lainnya.Hidrokarbon



HidrokarbonFatimahFF
Ã˝
Hidrokarbon merupakan senyawa karbon yang tersusun atas karbon dan hidrogen. Terbagi menjadi alifatik, siklik, dan aromatik. Alifatik terbagi lagi menjadi jenuh (alkana) dan tak jenuh (alkena, alkuna). Alkana memiliki ikatan tunggal, alkena ikatan rangkap dua, alkuna ikatan rangkap tiga. Hidrokarbon digunakan sebagai bahan bakar, pelarut, dan bahan baku senyawa organik lTatanama senyawa karbon



Tatanama senyawa karbonSMA Negeri 9 KERINCI
Ã˝
Dokumen tersebut memberikan penjelasan tentang penamaan senyawa organik seperti alkohol, eter, aldehida, keton, asam karboksilat, ester, dan haloalkana. Secara singkat, dokumen tersebut menjelaskan rumus umum, gugus fungsional, dan aturan penamaan IUPAC untuk kelompok senyawa organik tersebut.Lembar Kerja Siswa Kimia



Lembar Kerja Siswa KimiaCrj Ilfan Al-fan
Ã˝
Lembar kerja siswa ini berisi soal-soal mengenai identifikasi unsur karbon, hidrogen, dan oksigen dalam senyawa organik melalui reaksi pembakaran. Soal juga membahas kekhasan atom karbon dalam membentuk ikatan kovalen ganda dan rantai karbon panjang. Terdapat pula soal mengenai perbedaan atom karbon primer, sekunder, dan tersier beserta contoh perhitungannya.Senyawa Hidrokarbon kelas xi Kurikulum 2013



Senyawa Hidrokarbon kelas xi Kurikulum 2013Naufal Nabila
Ã˝
Kimia kelas XI Kurikulum 2013
Senyawa Karbon, sebelum belajar ke senyawa hidrokarbon. Ga ada salahnya kan buat belajar?Hidrokarbon



HidrokarbonLeni Roni
Ã˝
Dokumen tersebut merangkum tentang penggolongan hidrokarbon. Materi tersebut membahas tentang standar kompetensi, indikator, identifikasi senyawa karbon, penggolongan hidrokarbon berdasarkan kejenuhan ikatan, dan latihan soal tentang hidrokarbon.Kd ii meeting 1 (tep thp)



Kd ii meeting 1 (tep thp)Muhammad Luthfan
Ã˝
Mata kuliah tentang Alkana. Cari lebih banyak lagi di: http://muhammadhabibielecture.blogspot.com/2014/12/kuliah-semester-2.htmlHidrokarbon 



Hidrokarbon Sahril Sandrian
Ã˝
Dokumen tersebut membahas tentang senyawa karbon dan hidrogen seperti alkana, alkena, dan alkuna. Memberikan penjelasan tentang struktur, nama sistematis, sifat fisika dan kimia, serta contoh-contoh senyawa tersebut.Soal hidrokarbon



Soal hidrokarbonliawatiemi
Ã˝
Teks membahas tentang senyawa hidrokarbon khususnya yang terkandung dalam minyak bumi beserta proses destilasinya. Terdapat 30 pertanyaan pilihan ganda mengenai jenis-jenis senyawa hidrokarbon, sifatnya, dan aplikasinya dalam kehidupan sehari-hari seperti bahan bakar dan obat-obatan. Teks memberikan penjelasan mendetail tentang komposisi kimiawi minyak bumi dan senyawa-senyawa turunAlkana alkena-alkuna



Alkana alkena-alkunaEdi Haryanta
Ã˝
Alkuna merupakan senyawa hidrokarbon tak jenuh yang memiliki satu ikatan rangkap tiga. Alkuna memiliki sifat fisika dan kimia yang mirip dengan alkena namun lebih reaktif karena adanya ikatan rangkap tiga. Alkuna dapat mengalami berbagai reaksi seperti adisi, reduksi, hidrasi, dan polimerisasi.Hidrokarbon-1



Hidrokarbon-1Kadek Yuliya Dewi Astuti
Ã˝
Atom karbon memiliki kemampuan untuk membentuk ikatan kovalen ganda dan rantai karbon melalui ikatan antara atom-atom karbon. Ada berbagai jenis senyawa karbon dan hidrokarbon yang dapat dibedakan berdasarkan jenis ikatannya seperti jenuh, tak jenuh, serta sifat rantainya seperti alifatik, alisiklik, dan aromatik.hidrokarbon-160824130420.pdf



hidrokarbon-160824130420.pdfZidnaHaidar
Ã˝
Bab 1 membahas hidrokarbon dan minyak bumi, Bab 2 membahas termodinamika, Bab 3 membahas laju reaksi, dan Bab 4 membahas kesetimbangan kimia."Hidrokarbon-Kimia Kelas 11/XI SMA



Hidrokarbon-Kimia Kelas 11/XI SMABagas Pramana
Ã˝
Dari : Ibu Erawati Pamong Kimia SMA Taruna Nusantara. Berisi tentang materi hidrokarbon. Semoga berguna, bermanfaat, dan membantuMore Related Content
What's hot (18)
Tatanama senyawa karbon



Tatanama senyawa karbonSMA Negeri 9 KERINCI
Ã˝
Dokumen tersebut memberikan penjelasan tentang penamaan senyawa organik seperti alkohol, eter, aldehida, keton, asam karboksilat, ester, dan haloalkana. Secara singkat, dokumen tersebut menjelaskan rumus umum, gugus fungsional, dan aturan penamaan IUPAC untuk kelompok senyawa organik tersebut.Lembar Kerja Siswa Kimia



Lembar Kerja Siswa KimiaCrj Ilfan Al-fan
Ã˝
Lembar kerja siswa ini berisi soal-soal mengenai identifikasi unsur karbon, hidrogen, dan oksigen dalam senyawa organik melalui reaksi pembakaran. Soal juga membahas kekhasan atom karbon dalam membentuk ikatan kovalen ganda dan rantai karbon panjang. Terdapat pula soal mengenai perbedaan atom karbon primer, sekunder, dan tersier beserta contoh perhitungannya.Senyawa Hidrokarbon kelas xi Kurikulum 2013



Senyawa Hidrokarbon kelas xi Kurikulum 2013Naufal Nabila
Ã˝
Kimia kelas XI Kurikulum 2013
Senyawa Karbon, sebelum belajar ke senyawa hidrokarbon. Ga ada salahnya kan buat belajar?Hidrokarbon



HidrokarbonLeni Roni
Ã˝
Dokumen tersebut merangkum tentang penggolongan hidrokarbon. Materi tersebut membahas tentang standar kompetensi, indikator, identifikasi senyawa karbon, penggolongan hidrokarbon berdasarkan kejenuhan ikatan, dan latihan soal tentang hidrokarbon.Kd ii meeting 1 (tep thp)



Kd ii meeting 1 (tep thp)Muhammad Luthfan
Ã˝
Mata kuliah tentang Alkana. Cari lebih banyak lagi di: http://muhammadhabibielecture.blogspot.com/2014/12/kuliah-semester-2.htmlHidrokarbon 



Hidrokarbon Sahril Sandrian
Ã˝
Dokumen tersebut membahas tentang senyawa karbon dan hidrogen seperti alkana, alkena, dan alkuna. Memberikan penjelasan tentang struktur, nama sistematis, sifat fisika dan kimia, serta contoh-contoh senyawa tersebut.Soal hidrokarbon



Soal hidrokarbonliawatiemi
Ã˝
Teks membahas tentang senyawa hidrokarbon khususnya yang terkandung dalam minyak bumi beserta proses destilasinya. Terdapat 30 pertanyaan pilihan ganda mengenai jenis-jenis senyawa hidrokarbon, sifatnya, dan aplikasinya dalam kehidupan sehari-hari seperti bahan bakar dan obat-obatan. Teks memberikan penjelasan mendetail tentang komposisi kimiawi minyak bumi dan senyawa-senyawa turunAlkana alkena-alkuna



Alkana alkena-alkunaEdi Haryanta
Ã˝
Alkuna merupakan senyawa hidrokarbon tak jenuh yang memiliki satu ikatan rangkap tiga. Alkuna memiliki sifat fisika dan kimia yang mirip dengan alkena namun lebih reaktif karena adanya ikatan rangkap tiga. Alkuna dapat mengalami berbagai reaksi seperti adisi, reduksi, hidrasi, dan polimerisasi.Similar to Hidrokarbon 1 (20)
Hidrokarbon-1



Hidrokarbon-1Kadek Yuliya Dewi Astuti
Ã˝
Atom karbon memiliki kemampuan untuk membentuk ikatan kovalen ganda dan rantai karbon melalui ikatan antara atom-atom karbon. Ada berbagai jenis senyawa karbon dan hidrokarbon yang dapat dibedakan berdasarkan jenis ikatannya seperti jenuh, tak jenuh, serta sifat rantainya seperti alifatik, alisiklik, dan aromatik.hidrokarbon-160824130420.pdf



hidrokarbon-160824130420.pdfZidnaHaidar
Ã˝
Bab 1 membahas hidrokarbon dan minyak bumi, Bab 2 membahas termodinamika, Bab 3 membahas laju reaksi, dan Bab 4 membahas kesetimbangan kimia."Hidrokarbon-Kimia Kelas 11/XI SMA



Hidrokarbon-Kimia Kelas 11/XI SMABagas Pramana
Ã˝
Dari : Ibu Erawati Pamong Kimia SMA Taruna Nusantara. Berisi tentang materi hidrokarbon. Semoga berguna, bermanfaat, dan membantuKIMIA_KARBON_power_point.pptx



KIMIA_KARBON_power_point.pptxyusmiharti
Ã˝
Dokumen tersebut membahas berbagai jenis senyawa karbon seperti isomer, gugus fungsional, hidrokarbon, alkana, alkena, alkohol, eter, aldehida, keton, asam karboksilat, ester, lemak, minyak, dan haloalkana. Secara singkat, dokumen tersebut menjelaskan definisi, tatanama, sifat kimia, dan contoh dari berbagai senyawa karbon dasar.Kimia Organik (Aldehid dan keton)



Kimia Organik (Aldehid dan keton)nailaamaliaa
Ã˝
Read, follow, like and download. May be useful :)
thank youBab 5 senyawa karbon



Bab 5 senyawa karbon1habib
Ã˝
Bab ini membahas tentang senyawa karbon dan golongannya, terutama alkohol dan eter. Senyawa karbon dikelompokkan berdasarkan gugus fungsionalnya, seperti alkohol (rumus umum R-OH), eter (R-O-R'), aldehid, keton, asam karboksilat, dan ester. Alkohol dan eter merupakan isomer karena memiliki rumus molekul yang sama tetapi gugus fungsional yang berbeda. Alkohol dapat mengalamiSENYAWA KARBON TURUNAN ALKANA



SENYAWA KARBON TURUNAN ALKANADimah Sakdimah
Ã˝
Senyawa karbon turunan alkana terdiri dari haloalkana, alkanol, alkoksialkana, alkanal, alkanon, asam alkanoat, dan alkil alkanoat. Senyawa-senyawa ini memiliki gugus fungsi yang menentukan struktur dan sifatnya. Haloalkana dihasilkan dari reaksi alkana dengan halogen, sedangkan alkanol berasal dari penggantian atom H pada alkana dengan gugus hidroksil.Tugas_kimia.docx



Tugas_kimia.docxTIRASBALYO
Ã˝
Makalah ini membahas tentang senyawa karbon, termasuk ikatan senyawa karbon, alkohol, dan gugus-gugus fungsional seperti eter, aldehid, keton, asam karboksilat dan ester. Secara ringkas, makalah ini menjelaskan jenis ikatan karbon dan penamaan berbagai senyawa karbon.Modul kimia kelas xi bab 1



Modul kimia kelas xi bab 1mief04
Ã˝
Dokumen tersebut membahas tentang senyawa hidrokarbon, meliputi struktur dan sifatnya, tatanama, dan isomer. Secara khusus membahas tentang kekhasan atom karbon, penggolongan hidrokarbon berdasarkan ikatan antaratom karbonnya, serta contoh struktur dan tatanama alkana, alkena, dan alkuna.Hidrokarbon 



Hidrokarbon Rico L P U
Ã˝
Hidrokarbon adalah senyawa karbon dan hidrogen. Terdiri dari alkana (hidrokarbon jenuh), alkena (tak jenuh dengan ikatan rangkap dua), dan alkuna (ikatan rangkap tiga). Alkana terdiri dari rantai karbon dan hidrogen, seperti metana (CH4) dan heksana (C6H14). Hidrokarbon digunakan sebagai bahan bakar fosil dan bahan kimia industri.HIDROKARBON.pptx



HIDROKARBON.pptxAtikahAshriyaniSSi
Ã˝
Dokumen tersebut membahas tentang hidrokarbon, yaitu senyawa karbon yang terdiri dari atom karbon dan hidrogen. Juga membahas tentang alkana, alkena, dan alkuna sebagai jenis hidrokarbon jenuh dan tidak jenuh serta sifat dan manfaatnya. Selain itu, dibahas juga tentang proses pengolahan minyak bumi dan mutu bahan bakar minyak.More from olanascorepta (20)
ppt koloid.pptx



ppt koloid.pptxolanascorepta
Ã˝
Koloid merupakan sistem dispersi yang terdiri dari partikel yang terdispersi dalam medium. Terdapat tiga jenis sistem dispersi berdasarkan ukuran dan kestabilannya, yaitu suspensi, koloid, dan larutan. Koloid memiliki sifat optik seperti efek Tyndall dan gerak Brown, serta dapat dipisahkan menggunakan koagulasi, elektroforesis, dan dialisis. Ada beberapa cara pembuatan dan pemisahan koloid.Skl upload



Skl uploadolanascorepta
Ã˝
Dokumen tersebut membahas tentang konsentrasi larutan, kemolalan, fraksi mol, serta soal-soal terkaitnya. Terdapat penjelasan mengenai konsentrasi molar, molal, dan fraksi mol beserta contoh perhitungannya. Juga terdapat beberapa soal untuk latihan menghitung konsentrasi larutan.Quiz stoikiometri



Quiz stoikiometriolanascorepta
Ã˝
Dokumen tersebut membahas beberapa soal kimia yang terkait dengan stoikiometri reaksi kimia, meliputi perhitungan massa dan volume produk reaksi, jumlah mol zat yang terbentuk dan sisa, serta perhitungan kadar unsur dalam senyawa kimia.Ppt mbs



Ppt mbsolanascorepta
Ã˝
Etilena glikol dihasilkan dari reaksi etilen oksida dan air dengan perbandingan 1:1 yang menghasilkan 3 molekul etilena glikol dan 2 molekul air sisa. Logam besi 28 g bereaksi dengan oksigen 48 g menghasilkan besi oksida (Fe2O3) sebesar 40 g dan oksigen sisa 36 g.Ppt re dan rm



Ppt re dan rmolanascorepta
Ã˝
Siswa belajar tentang rumus empiris dan rumus molekul, termasuk cara menentukan kedua rumus tersebut berdasarkan data komposisi unsur dan massa molekul relatif senyawa. Tujuan pembelajaran adalah agar siswa mampu membedakan dan menghitung rumus empiris dan rumus molekul secara tepat.Stoikimetri 4



Stoikimetri 4olanascorepta
Ã˝
Dokumen tersebut memberikan penjelasan tentang konsep-konsep stoikiometri seperti mol, molalitas, molaritas, dan hukum gas. Juga memberikan contoh soal perhitungan jumlah mol, jumlah partikel, volume, dan tekanan gas oksigen berdasarkan data massanya.Stoikiometri 3



Stoikiometri 3olanascorepta
Ã˝
Dokumen tersebut membahas hukum gas ideal dan hukum Avogadro dalam menghitung volume dan jumlah mol gas pada tekanan dan suhu tertentu. Persamaan gas ideal digunakan untuk menghitung volume, jumlah mol, atau tekanan gas bila dua variabel diketahui. Hukum Avogadro menyatakan bahwa volume dua gas sama pada tekanan dan suhu yang sama akan berbanding lurus dengan jumlah molnya. Dokumen ini juga menjelaskanPpt stoikimetri 1



Ppt stoikimetri 1olanascorepta
Ã˝
Dokumen ini membahas konsep mol sebagai satuan untuk mengukur jumlah partikel dalam suatu zat. Mol didefinisikan sebagai jumlah partikel yang sama dengan jumlah atom dalam 12 gram karbon-12. Tetapan Avogadro menyatakan bahwa dalam mol terdapat 6,02x1023 partikel. Dokumen ini juga menjelaskan hubungan antara mol dengan jumlah partikel, massa, dan volume gas pada kondisi standar tekanan dan suhu. DiakPpt ksp



Ppt kspolanascorepta
Ã˝
The document discusses several topics related to solubility including:
- Solubility product constant (Ksp) and its relationship to solubility. The Ksp expression is given for different types of salts.
- Factors that influence solubility such as common ions, pH, and temperature. The presence of common ions decreases solubility while increasing pH or temperature increases solubility.
- Precipitation reactions and how to predict if precipitation will occur based on Ksp values and ion concentrations.Rpp kelarutan dan_hasil_kali_kelarutan



Rpp kelarutan dan_hasil_kali_kelarutanolanascorepta
Ã˝
1. The document outlines a lesson plan on the topic of solubility and solubility product constant for an 11th grade chemistry class.
2. The plan includes learning objectives, indicators, materials, and methods such as experiments, discussions, and assignments to help students understand solubility, saturation, solubility product constants, and their relationships.
3. Students will conduct experiments on the solubility of salts like NaCl and CaCO3, analyze the results, and make predictions about precipitation based on solubility rules and solubility product constants.Recently uploaded (20)
Kisi- kisi Ujian Madrasah Baha Indonesia 2025.docx



Kisi- kisi Ujian Madrasah Baha Indonesia 2025.docxKhusnulAzizah4
Ã˝
kisi kisi ujian madrasah bahasa indonesiaIntroduction to Building Maintenance & Preventive Maintenance _Training *Proa...



Introduction to Building Maintenance & Preventive Maintenance _Training *Proa...Kanaidi ken
Ã˝
Narasumber/ Pemateri Training: Kanaidi, SE., M.Si., cSAP., CBCM
HP/Wa Kanaidi: 0812 2353 284,
e-mail : kanaidi63@gmail.com
---------------------------------------- BUNGAI JAKU SEMPAMA dikena bala pengajar Iban nyadika malin dalam ngajar.



BUNGAI JAKU SEMPAMA dikena bala pengajar Iban nyadika malin dalam ngajar.SantaMartina2
Ã˝
∫›∫›fl£ tu digaga Pengajar Medan Ak Radin lalu dikunsi ba ditu nyadika malin bala pengajar ti begunaka kereban senentang Jaku Iban. Komsas: Justeru Impian Di Jaring (Tingkatan 3)



Komsas: Justeru Impian Di Jaring (Tingkatan 3)ChibiMochi
Ã˝
Buku Skrap Kupasan Novel ‘Justeru Impian Di Jaring’ yang lengkap bersertakan contoh yang padat. Reka bentuk isi buku yang menarik mampu menarik minat untuk membaca. Susunan ayat yang teratur dapat menyenangkan ketika mahu mencari nota.Info PELAKSANAAN + Link2 MATERI Training "Teknik Perhitungan dan Verifikasi T...



Info PELAKSANAAN + Link2 MATERI Training "Teknik Perhitungan dan Verifikasi T...Kanaidi ken
Ã˝
bagi Para Karyawan *PT. Tri Hasta Karya (Cilacap)* yang diselenbggarakan di *Hotel H! Senen - Jakarta*, 24-25 Februari 2025.
-----------
Narasumber/ Pemateri Training: Kanaidi, SE., M.Si., cSAP., CBCM
HP/Wa Kanaidi: 0812 2353 284,
e-mail : kanaidi63@gmail.com
---------------------------------------- MATERI KE 3 BACAAN MAD (PANJANG) TAHSIN 2025



MATERI KE 3 BACAAN MAD (PANJANG) TAHSIN 2025BangZiel
Ã˝
Materi ini membahas hukum bacaan Mad (panjang) dalam ilmu tajwid, yang terjadi ketika ada huruf mad (ÿß, Ÿà, Ÿä) dalam bacaan Al-Qur'an. Pembahasan mencakup jenis-jenis mad, hukum bacaan, serta panjangnya dalam harakat.PPT Qurdis Bab 4 kelas IX MTs/SMP SMT 2.pptx



PPT Qurdis Bab 4 kelas IX MTs/SMP SMT 2.pptxhendipurnama1
Ã˝
Materi terkait ayat-ayat Gharib di AlquranBERBICARA FORMAL, NONFORMAL, DAN PRESENTASI.pptx



BERBICARA FORMAL, NONFORMAL, DAN PRESENTASI.pptxputuariutama
Ã˝
BERBICARA FORMAL, NONFORMAL, DAN PRESENTASI1 Auditing II-Power Point AUDIT SIKLUS PENJUALAN DAN PENAGIHAN: PENGUJIAN PEN...



1 Auditing II-Power Point AUDIT SIKLUS PENJUALAN DAN PENAGIHAN: PENGUJIAN PEN...nhkfadhilah
Ã˝
1 Auditing II-Power Point.pptxPengumpulan data- Askeb komunitas-Pertemuan 10



Pengumpulan data- Askeb komunitas-Pertemuan 10AyiDamayani
Ã˝
Pertemuan 10 pengumpulan data askeb komunitasPertemuan 01. Pendahuluan Statistika Informatika



Pertemuan 01. Pendahuluan Statistika InformatikaAsepSaepulrohman4
Ã˝
Statistika memiliki peranan penting dalam ilmu komputer, terutama dalam bidang analisis data, pembelajaran mesin, dan pengembangan algoritma. TADABUR SURAH AL WAQIAH.pptxddddddddddddddddddd



TADABUR SURAH AL WAQIAH.pptxdddddddddddddddddddwan hanif wan ahmad
Ã˝
eeeeeeeeeeeeeeeeeddddddddddddddddHidrokarbon 1
- 1. Atom Karbon dan Hydrokarbon-1
- 2. PERBEDAAN SENYAWA KARBON DAN SENYAWA HIDROKARBON senyawa yang mengandung tidak hanya unsur C dan H tetapi juga unsur lain seperti O , N , S , P atau halogen senyawa yang mengandung hanya C dan H saja * Alkanol * Alkoksi alkana * Alkanal * Alkanon * Alkanoat * Alkil alkanoat Alkana Alkena Alkuna
- 3. Mengenang masa lalu Carbon sebagai unsur pokok memiliki keistimewaan sbb : • Dengan ev = 4 membentuk 4 ikatan kovalen Sbb : | ― C ― | 2. Dapat membentuk rantai karbon , yaitu ikatan antara atom karbon yang satu dengan atom karbon yang lain.
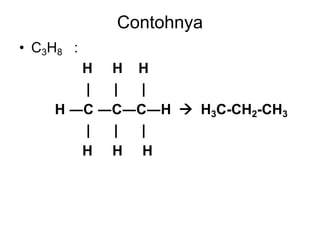
- 4. Contohnya • C3H8 : H H H | | | H ―C ―C―C―H  H3C-CH2-CH3 | | | H H H
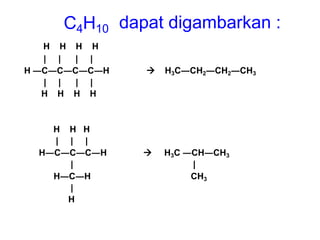
- 5. C4H10 dapat digambarkan : H H H H | | | | H ―C―C―C―C―H  H3C―CH2―CH2―CH3 | | | | H H H H H H H | | | H―C―C―C―H |  H3C ―CH―CH3 | H―C―H | CH3 H
- 6. Perhatikan istilah ini Rantai alifatik Rantai alisiklik • Rantai karbon yang terbuka disebut : • Rantai karbon yang tertutup disebut : • Rantai karbon yang hanya dihubungkan oleh ikatan tunggal disebut rantai jenuh • Rantai karbon yang hanya dihubungkan oleh ikatan rangkap baik rangkap 2 atau rangkap 3 disebut rantai tak jenuh • Rantai karbon alisiklik yang memiliki ikatan konyugasi yaitu ikatan tunggal dan rangkap selang seling disebut Rantai karbon aromatik.
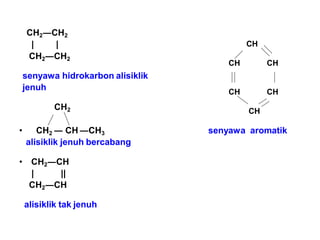
- 7. CONTOH SOAL • H3C―CH2―CH2―CH3  Senyawa hidrokarbon alifatik jenuh • H3C ―CH―CH- OH | CH3  Senyawa karbon alifatik jenuh bercabang. • H3C―CH = CH―CH3  Senyawa hidrokarbon alifatik tak jenuh 0 ║ • H3C ―CH―CH2 - C |  Senyawa karbon alifatik bercabang H CH3
- 8. CH2―CH2 | | CH2―CH2 senyawa hidrokarbon alisiklik jenuh CH2 • CH2 ― CH ―CH3 alisiklik jenuh bercabang senyawa aromatik • CH2―CH | || CH2―CH alisiklik tak jenuh CH CH CH CH CH CH
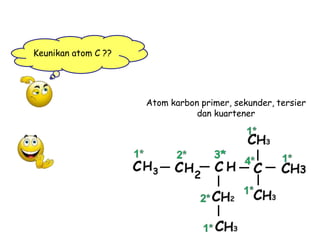
- 9. Atom karbon primer, sekunder, tersier dan kuartener Keunikan atom C ??
- 10. ADA 4 JENIS ATOM C • Atom C primer : bila atom C mengikat 1 yang Lain. : bila atom C mengikat 2 yang Lain : bila atom C mengikat 3 yang Lain • Atom C secunder • Atom C Tersier • Atom C kwarterner : bila atom C mengikat 4 yang Lain.
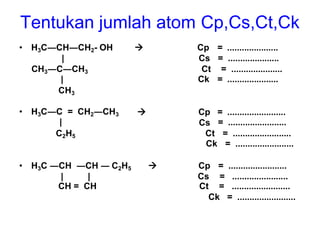
- 11. Tentukan jumlah atom Cp,Cs,Ct,Ck • H3C―CH―CH2- OH |  Cp Cs = ..................... = ..................... CH3―C―CH3 | Ct Ck = ..................... = ..................... CH3 • H3C―C = | CH2―CH3  Cp Cs = = ........................ ........................ C2H5 Ct Ck = ........................ = ........................ • H3C ―CH ―CH ― C2H5 | |  Cp Cs = = ........................ ....................... CH = CH Ct = ........................ Ck = ........................
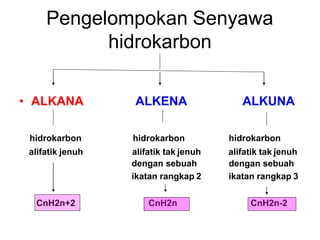
- 12. Pengelompokan Senyawa hidrokarbon • ALKANA ALKENA ALKUNA hidrokarbon hidrokarbon hidrokarbon alifatik jenuh alifatik tak jenuh dengan sebuah ikatan rangkap 2 alifatik tak jenuh dengan sebuah ikatan rangkap 3 CnH2n+2 CnH2n CnH2n-2
- 13. T H A N KY O U









































