Hva Er Medisinsk Forskning September 2009
- 1. Hva er medisinsk forskning? MF 9000 Medisinsk forskningsmetode professor dr.med. Magne Nylenna
- 2. ╠²
- 3. Forskning har ikke v├”rt noe dominerende valgkamptema
- 4. I St. meld. nr. 30 (2008ŌĆō2009) Klima for forskning, peker regjeringen ut kursen for norsk forskningspolitikk i ├źrene framover. Norsk forskning skal m├Ėte de globale utfordringene, videreutvikle velferdssamfunnet og legge grunnlaget for morgendagens verdiskaping. Samtidig skal forskningen utvikle Norge som kunnskaps- og kulturnasjon.
- 7. ╠²
- 8. ╠²
- 9. Noen begreper Forskning Vitenskap Research
- 10. Hva er forskning? forskning , prosess som gjennom systematisk arbeid kan frembringe nye kunnskaper og ├Ėkt viten. Forskning foreg├źr hovedsakelig ved universiteter og h├Ėyskoler (som har forskning som hovedoppgave ved siden av undervisning), frittst├źende forskningsinstitutter og i n├”ringslivets laboratorier som del av en industribedrift. Begrepet vitenskap brukes ogs├ź s├”rlig om den akademiske forskning. Store norske leksikon (snl.no)
- 11. Hva er forskning? ŌĆØ Forskning er virksomhet av original karakter som utf├Ėres med vitenskapelig metodikk for ├ź skaffe tilveie ny kunnskap.ŌĆØ OECD
- 12. Hva er forskning? ŌĆØ Forskning er produksjon av ny forst├źelse av virkeligheten gjennom bearbeidelse av fakta.ŌĆØ Albert Einstein (1879 ŌĆō 1955)
- 13. Hva karakteriserer forskning? Jakt p├ź et svar, s├Ėken etter kunnskap Bruk av en vitenskapelig metode Systematisk tiln├”rming God dokumentasjon Publisering av resultater Etiske prinsipper
- 14. Prinsipper ved forskning Sannhetsforpliktelsen Ærlighetskravet Fullstendighetsidealet Systematiske feil forebygges ved god design Tilfeldige feil korrigeres det for ved statistiske metoder Erkjennelsesfeil tar historien seg av....
- 15. ╠²
- 16. To fenomener ŌĆō som begge m├ź forhindres Svindel (fraud) Fabrikasjon Forfalskning Plagiering Uredelighet (misconduct) ŌĆØ alle alvorlige brudd p├ź akseptert forskningsetisk praksis i planlegging, gjennomf├Ėring eller rapportering av forskningŌĆØ
- 17. ╠²
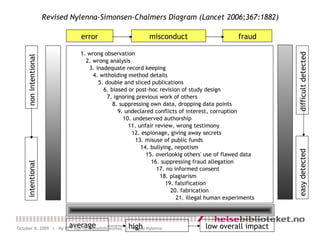
- 18. 1. wrong observation 2. wrong analysis 3. inadequate record keeping 4. witholding method details 5. double and sliced publications 6. biased or post-hoc revision of study design 7. ignoring previous work of others 8. suppressing own data, dropping data points 9. undeclared conflicts of interest, corruption 10. undeserved authorship 11. unfair review, wrong testimony 12. espionage, giving away secrets 13. misuse of public funds 14. bullying, nepotism 15. overlookig others' use of flawed data 16. suppressing fraud allegation 17. no informed consent 18. plagiarism 19. falsification 20. fabrication 21. illegal human experiments error misconduct fraud Revised Nylenna-Simonsen-Chalmers Diagram (Lancet 2006;367:1882) non intentional intentional difficult detected easy detected average high low overall impact
- 19. Hva er medisinsk forskning? ŌĆØ Medisinsk og helsefaglig forskning: Virksomhet som utf├Ėres med vitenskapelig metodikk for ├ź skaffe til veie ny kunnskap om helse og sykdomŌĆØ Helseforskningsloven ┬¦ 4 a)
- 20. Lov om medisinsk og helsefaglig forskning Loven gjelder for medisinsk og helsefaglig forskning p├ź mennesker, humant biologisk materiale eller helseopplysninger. Helseforskningsloven ┬¦ 2
- 21. ╠²
- 22. Hva er medisinsk forskning? Forskning vs utpr├Ėvende behandling evaluering kvalitetssikring utredning markedsf├Ėring Medisinsk vs helsefaglig samfunnsvitenskaplig (eks. helsetjenesteforskning) humanistisk
- 23. Hva er karakteristisk for medisinsk forskning? Det dreier seg om mennesker Mennesker har egenvilje.. ... og etiske og juridiske rettigheter Mennesker endrer.. levevaner adresse sivilstatus navn kj├Ėnn ......
- 24. Lasagnas lov ŌĆØ I det unders├Ėkelsen starter avtar tilstandens hyppighet til 1/10 av det den tidligere varŌĆØ
- 25. Etiske prinsipper ved medisinsk forskning ŌĆØ Hensynet til fors├Ėkspersonen m├ź alltid g├ź foran vitenskapens og samfunnets interesserŌĆØ (Helsinkideklarasjonen) Pasienter skal aldri skades alltid ha mulighet for ├ź si nei
- 26. Informert samtykke tilstrekkelig informasjon skal v├”re gitt tilstrekkelig informasjon skal v├”re forst├źtt samtykket skal v├”re frivillig vedkommende skal v├”re kompetent til ├ź gi samtykke
- 27. ╠²
- 28. ╠²
- 29. Forskningsmetoder Deskriptive beskrivelse av virkeligheten Analytiske testing av en eller flere hypoteser
- 30. Deskriptive metoder kasuistikker deskriptiv epidemiologi kvalitative prosjekter
- 31. Hypoteser antagelser som kan bekreftes (verifiseres) eller avkreftes (falsifiseres) hypoteser m├ź v├”re entydig formulert ikke inneholde verdiladede ord uttrykke forhold som er m├źlbare
- 32. Analytiske metoder Observasjonelle tverrsnittsstudier case-controlstudier kohortstudier Eksperimentelle metoder kontrollerte kliniske fors├Ėk intervensjonsstudier
- 33. Metoden m├ź velges utifra sp├Ėrsm├źlet Hvor mange har et problem (forekomst)? Hvorfor f├źr noen dette problemet, mens andre holder seg friske (etiologi/├źrsak)? Hvordan kan vi avgj├Ėre om noen har dette problemet (diagnostikk/m├źleinstrument)? Hva kan vi gj├Ėre for ├ź forebygge eller behandle problemet? (effekt av tiltak)? Hvordan g├źr det med den som har problemet (prognose)? Hvordan oppleves det ├ź ha dette problemet (erfaringer)?
- 34. Tverrsnittsunders├Ėkelser Hypoteser testes ved ├ź unders├Ėke et tverrsnitt i befolkningen Alt skjer p├ź ett tidspunkt M├ź finne et riktig utvalg (representativitet) Kan ikke forklare ├źrsakssammenhenger
- 35. ├ģrsakssammenhenger En p├źvist sammenheng er ikke et bevis p├ź ├źrsakssammenheng (kausalitet) St├Ėtte for ├źrsakssammenheng sammenhengen er ŌĆØlogiskŌĆØ sammenhengen er sterk tidsfaktoren stemmer dose/respons sammenheng funnene er konsistente og reproduserbare
- 36. Case-controlstudier Retrospektive studier (ser tilbake i tid) Sammenlikner ŌĆØcasesŌĆØ (syke) med kontroller (friske) for ├ź finne forskjeller S├”rlig godt egnet for sjeldne tilstander Metodeproblemer bias valg av kontroller
- 37. Case-controlstudie Case (personer med sykdom) Kontroller (personer uten sykdom) Tid Forskning Utsatt Ikke Utsatt Utsatt Ikke Usatt
- 38. Kohortstudie Prospektiv (ser fremover i tid) Sammenlikner en gruppe med en egenskap/eksposisjon og en gruppe uten denne egenskapen/eksposisjonen Krevende, kostbare unders├Ėkelser
- 39. Populasjon Eksponert Ueksponert Utfall Utfall Kohortstudie
- 40. Eksperimentelle unders├Ėkelser Man griper selv inn i det som skjer M├źlet er full kontroll over alle forhold Man s├Ėker ├ź isolere det fenomenet som vil studeres ved ├ź korrigere for andre faktorer
- 41. Kontrollerte kliniske fors├Ėk Randomized controlled trials (RCT) F├Ėlger pasientene fremover i tid (som kohortstudier) Sammenlikner intervensjonsgruppe med kontrollgruppe Randomisering
- 42. Randomisert kontrollert fors├Ėk (RCT) gruppe 1 gruppe 2 populasjon utfall nytt tiltak utfall kontroll
- 43. ╠²
- 44. Legemiddelfors├Ėk Fase I: orienterende unders├Ėkelse p├ź f├ź, friske personer Fase II: pilotfors├Ėk for ├ź teste terapeutiske virkninger Fase III: kontrollerte fors├Ėk med store pasientgrupper Fase IV: ytterligere studier etter registrering
- 45. Hva er god forskning? ŌĆØ Forskning er produksjon av ny forst├źelse av virkeligheten gjennom bearbeidelse av fakta. Forskning er god i den grad den gir enkle utsagn med mest mulig generell gyldighetŌĆØ Albert Einstein (1879 ŌĆō 1955)
- 46. God forskning Forskning av h├Ėy kvalitet (faglig forsvarlig), som kan gi kunnskap om helse og sykdom, og.. som ivaretar deltakernes velferd og integritet (etisk og medisinsk forsvarlig)
- 47. Gerhard Henrik Armauer Hansen (1841-1912)
- 48. Utskrift av Byfogd og Byskriver i Bergen: Domsprotokoll nr 16, 1878-1882 fol. 227. Aar 1880 den 31te Mai blev inden Bergens Extraret i Sag No99/1880 Justitien mod Gerhard Henrik Armauer Hansen afsagt f├Ėlgende Dom: Ved Kongl. Resolution af 17 April d. A. er L├”ge ved Pleistiftelsen for Spedalske No 1, constitueret Overl├”ge for den spedalske Sygdom Gerhard Henrik Armauer Hansen undergiven Justitiens Tiltale for den 3die Nvbr 1879 at have stukket den i n├”vnte Pleistiftelse indlagte Pige, Kari Nielsdatter Spids├Ėen i ├śiet med en st├”rnaal, der kort i Forveien var f├Ėrt gjennem en Knude hos en af den knudede Form af Spedalshed lidende Patient......
- 49. reguleŌĆÖre , v., bringe i orden, innrette; bestemme, fastsette. Regulering
- 50. Utviklingstrekk G. Armauer Hansen (1880) N├╝rnberg (1947) Helsinki-deklarasjonen (1964) Menneskerettighetskonvensjonene (1966) Regionale etikkomiteer (1985) Mer rettighetstenkning (WhatŌĆÖs in it for me?) ├śkende antall lover og regler........
- 51. 1. ├ģ gi en fremstilling av dagens regulering av medisinsk og helsefaglig forskning 2. ├ģ vurdere hensiktsmessigheten av denne reguleringen 3. ├ģ foresl├ź eventuelle endringer i forskningsreguleringen Forskningsreguleringsutvalgets (ŌĆØNylenna-utvalgetŌĆØ) mandat
- 52. ╠²
- 54. Norske lover Straffeloven Forvaltningsloven Patentloven Offentlighetsloven Transplantasjonsloven Abortlova Barneloven Kommunehelsetjenesteloven Produktansvarsloven Legemiddelloven, med forskrift om klinisk utpr├Ėving av legemidler Genteknologiloven Smittevernloven Lov om medisinsk utstyr Lov om universiteter og h├Ėgskoler Menneskerettsloven med vedlegg Spesialisthelsetjenesteloven Psykisk helsevernlov Pasientrettighetsloven Helsepersonelloven Personopplysningsloven Helseregisterloven Pasientskadeloven Biobankloven Bioteknologiloven Internasjonale reguleringer N├╝rnbergkodeksen Helsinkideklarasjonen FN konvensjonen for sivile og politiske rettigheter med tilleggsprotokoller FN konvensjonen om ├Ėkonomiske, sosiale og kulturelle rettigheter Guidelines for good clinical practice (GCP) for trials on pharmaceutical products Universal Declaration on the Human Genome and Human Rights (1997) Resolution on Human Rights and Bioethics Operational Guidelines for Ehtics Committees That Review Biomedical Research International Ethical Guidelines for Biomedical Research Involving Human Subjects Den europeiske menneskerettighetskonvensjon med tilleggsprotokoller Konvensjon om menneskerettigheter og biomedisin med tilleggsprotokoller Direktiv 1995/46/EF om behandling og utveksling av personopplysninger Direktiv 2001/20/EF om klinisk fors├Ėk av legemidler Andre norske reguleringer Etiske regler for leger Retningslinjer for samarbeid mellom legestand og farmas├Ėytisk industri Reguleringer for andre grupper helsepersonell Lokale reguleringer, vedtekter mm Mandat for De regionale komiteer for medisinsk forskningsetikk
- 55. Overraskende observasjoner Langt mer detaljerte reguleringer av forskning p├ź biologisk materiale og helseopplysninger enn forskning p├ź mennesker Helsinkideklarasjonen oppfattes av noen som ŌĆØbare veiledendeŌĆØ og ŌĆØbare for legerŌĆØ
- 56. FORSKEREN Erfaring/problemopplevelse - Ide ŌĆō Planlegging ŌĆō prosjektbeskrivelse Kartlegging ŌĆō Metodevalg ŌĆō Datainnsamling/eksperiment ŌĆō Analyse ŌĆō Tolkning ŌĆō Patentering - Publikasjon - Anvendelse ╠² Regionale forskningsetiske komiteer (REK) (alle prosjekter) 1. Gir r├źd til forskeren om endringer i prosjektet. 2. Tilr├źr/Frar├źr - det enkelte forskningsprosjektet - forskningsbiobanker ╠² LEGEMIDDELVERKET (Klinisk utpr├Ėving av legemidler) Kan foresl├ź endringer Godkjenner/avsl├źr F├Ėrer tilsyn med gjennomf├Ėringen STATENS HELSETILSYN ŌĆō F├Ėrer tilsyn med helsetjenesten og helsepersonell ŌĆō dvs. ogs├ź en del forskere (alle faser) HELSE- OG OMSORGS-DEPARTEMENTET ╠² Skal ha melding om opprettelse av forskningsbiobanker; kan nekte. ╠² DATATILSYNET (forskning som inneb├”rer behandling av personopplysninger) - Behandler konsesjons├Ėkn. Og mottar meldinger - Tilsynsmyndighet - Gir r├źd, veiledning og informasjon BIOTEKNOLOGINEMNDA Gir departementet r├źd i form av uttalelser. R├źdgir ogs├ź Shdir. ╠² PERSONVERNNEMNDA (Klageorgan for Datatilsynet) Norsk Samfunnsvitenskapelig datatjeneste AS (NSD) Data- og r├źdgivertjeneste for forskere (privat foretak). Bl.a. personvernombud for de fleste forskningsinstitusjoner. SOSIAL- OG HELSEDIREKTORATET Delegert myndighet, bl.a. ved utf├Ėrsel av biologisk materiale til utlandet, fritak fra taushetsplikt for helseopplysninger til forskning. Alle forvaltningsoppgaver etter bioteknologiloven. Godkjenner prosjekter som omhandler bruk av foster/vev. ANDRE FAGDEPARTEMENT Uttaler seg til hd. R├ģDET FOR TAUSHETSPLIKT OG FORSKNING Institusjon ŌĆō arbeidsgiver: Universitet, sykehus, privat foretak, industri, og lignende Finaniseringskilde, oppdragsgiver og lignende
- 57. Byr├źkrati Mange instanser ŌĆō dels overlappende Tid- og ressurskrevende Manglende tilsyn og oppf├Ėlgning
- 63. Interesseavveining ŌĆØ Hensynet til fors├Ėkspersonen m├ź alltid g├ź foran vitenskapens og samfunnets interesserŌĆØ (Helsinkideklarasjonen) ŌĆØ The interest and welfare of the human being shall prevail over the sole interest of society or scienceŌĆØ (Europar├źdets konvensjon om menneskerettigheter og biomedisin)
- 64. Fra ├ź ŌĆØunng├ź ├ź skadeŌĆØ Til ├ź ŌĆØunng├ź ├ź krenkeŌĆØ
- 65. Noen prinsipper Menneskeverdprinsippet Selvbestemmelsesprinsippet Forsvarlighetsprinsippet Risiko-nytteprinsippet Forskningsfrihetsprinsippet Faglighetsprinsippet Fellesskapsprinsippet Fortrolighetsprinsippet ├ģpenhetsprinsippet Forh├źndsvurderingsprinsippet primum non nocere Tre krav til god forskning: h├Ėy kvalitet original relevant M├ź ligge innen gjeldende etiske og juridiske rammer
- 66. Grunnprinsipp Hensynet til deltakerens velferd og integritet skal g├ź foran samfunnets og vitenskapens interesser Helseforskningsloven ┬¦ 5 Europar├źdets konvensjon om menneskerettigheter og biomedisin av 1997 (Oviedo-konvensjonen) Helsinki-deklarasjonen
- 67. Fra mange reguleringer til ├®n lov www.helseforskningsrett.no
- 68. ├ēn lov ŌĆō ├®n postkasse
- 69. ╠²
- 70. Helseforskningsloven ┬¦ 1 ŌĆØLovens form├źl er ├ź fremme god og etisk forsvarlig medisinsk og helsefaglig forskningŌĆØ
- 71. Grunnprinsipp Hensynet til deltakerens velferd og integritet skal g├ź foran samfunnets og vitenskapens interesser Helseforskningsloven ┬¦ 5 Europar├źdets konvensjon om menneskerettigheter og biomedisin av 1997 (Oviedo-konvensjonen) Helsinki-deklarasjonen
- 72. Kapittel 2: Organisering og ut├Ėvelse Forsvarlighetskrav (for alle involverte) Krav om forskningsansvarlig Krav om prosjektleder Krav om forskningsprotokoll der finansieringskilder m├ź fremg├ź Krav om internkontroll Taushetsplikt Forbud mot kommersiell utnyttelse
- 73. Krav om forsvarlig organisering Forskningsansvarlig Prosjektleder Forskningsprotokoll
- 74. Hvem er forskningsansvarlig? ŌĆ£ institusjon eller en annen juridisk eller fysisk person som ŌĆ” har det overordnede ansvaret for forskningsprosjektetŌĆØ (┬¦ 4) Systemansvarlig Overordnet ansvar for deltakernes ve og vel, forskningsbiobanker og personregistre
- 75. Hvem kan v├”re forskningsansvarlig? M├ź ha ŌĆ£de n├Ėdvendige forutsetningene for ├ź kunne oppfylle den forskningsansvarliges plikter etter denne lovenŌĆØ (┬¦ 4) M├ź v├”re ┬½organisert for og ha kapasitet til┬╗ ├ź ivareta forskningsaktiviteten Faglig (medisinsk og vitenskapelig) kompetanse Fysiske fasiliteter og ├Ėkonomi Instruksjons myndighet Kontroll mulighet
- 76. Kapittel 3: S├Ėknad og melding til REK Krav om forh├źndsgodkjenning fra REK For visse s├”romr├źder opprettholdes dagens ordning med krav om forh├źndsgodkjenning fra andre instanser: godkjenning av klinisk utpr├Ėvning av legemidler ’āĀ Legemiddelverket godkjenning av klinisk utpr├Ėvning av medisinsk utstyr ’āĀ Hdir godkjenning etter bioteknologiloven kapittel 5 og 6 ’āĀ Hdir S├Ėknadsplikt ved vesentlige endringer i prosjektet Krav om innsendelse av sluttmelding til REK om b├źde negative og positive funn
- 77. Kapittel 4 : Samtykke Utgangspunkt: krav til informert samtykke Visse modifikasjoner: Bredt samtykke (eks: kreftforskning) Utsatt samtykke i kliniske n├Ėdssituasjoner Ny eller endret bruk av materiale som tidligere er innsamlet til forskningsform├źl, dersom vanskelig ├ź innhente nytt samtykke REK godkjenner forskningen er n├Ėdvendig for ├ź utf├Ėre oppgave av allmenn interesse samfunnets interesse i at forskningen finner sted klart overstiger ulempene det medf├Ėrer for den enkelte
- 78. DessutenŌĆ”ŌĆ”ŌĆ”. ┬¦ 35. Adgang til bruk av helseopplysninger som er innsamlet i helsetjenesten til forskning ╠²╠²╠²╠²╠²╠² Den regionale komiteen for medisinsk og helsefaglig forskningsetikk kan bestemme at helseopplysninger kan eller skal gis fra helsepersonell til bruk i forskning, og at det kan skje uten hinder av taushetsplikt. Det samme gjelder opplysninger innsamlet i helsetjenesten. Dette kan bare skje dersom slik forskning er av vesentlig interesse for samfunnet og hensynet til deltakernes velferd og integritet er ivaretatt. Den regionale komiteen for medisinsk og helsefaglig forskningsetikk kan sette vilk├źr for bruken. Reglene om taushetsplikt etter ┬¦ 7 gjelder tilsvarende for den som mottar opplysningene. ╠²╠²╠²╠²╠²╠² Departementet kan i forskrift gi n├”rmere bestemmelser om bruk av taushetsbelagte opplysninger i forskning.
- 79. Kapittel 5: Forskning p├ź mennesker Utgangspunkt: skal ikke utf├Ėres hvis man har alternative, like gode metoder Risikovurdering f├Ėr igangsettelse Meldeplikt og informasjonsplikt
- 80. Kapittel 6: Humant biologisk materiale Behandles og oppbevares forsvarlig ikke gis ut til forsikringsselskap, arbeidsgiver, rettsvesen Materiale innsamlet i helsetjenesten kan benyttes i forskning uten samtykke fra den det gjelder strenge vilk├źr/REK avgj├Ėr reservasjonsregister Overf├Ėring til og fra utlandet krever godkjenning fra REK og samtykke fra den det gjelder Andre skal f├ź tilgang p├ź materiale dersom forskningsansvarlig ikke trenger det selv
- 81. Kapittel 7: Forskning p├ź helseopplysninger Harmonisert med reglene i personopplysningsloven og helseregisterloven Grad av personidentifikasjon m├ź ikke v├”re st├Ėrre enn n├Ėdvendig (avidentifisert som hovedregel for forsker) Helseopplysninger innsamlet i helsetjenesten/fra helsepersonell kan benyttes i forskning uten samtykke fra den det gjelder strenge vilk├źr/REK avgj├Ėr (dispensasjon fra taushetsplikt)
- 82. Kapittel 8: ├ģpenhet og innsyn Rett til innsyn for forskningsdeltaker og allmennheten, og unntak fra denne retten REK skal f├Ėre offentlig register over innmeldte og avsluttede forskningsprosjekter basert p├ź opplysninger i s├Ėknad og sluttmelding Positive og negative funn m├ź fremg├ź Mulighet for ├ź s├Ėke om utsatt offentliggj├Ėring der dette er n├Ėdvendig for ├ź beskytte legitime patentrettslige eller konkurransemessige interesser eller av hensyn til et l├Ėpende forskningsarbeid
- 83. Kapittel 9 og 10: Tilsyn og sanksjoner Statens helsetilsyn f├źr hjemmel for ├ź f├Ėre tilsyn med all medisinsk og helsefaglig forskning (ogs├ź utenfor helseforetak og der forskningen ikke utf├Ėres av helsepersonell) Datatilsynet (og Legemiddelverket) f├Ėrer tilsyn p├ź de omr├źdene de har ansvar for i dag ┬¦ 54 gir hjemmel for fengelsstraff ved forsettlig eller grovt uaktsom overtredelse av loven
- 84. ŌĆ£ Byr├źkratietŌĆØ Forskningsansvarlig/ Prosjektleder Statens legemiddelverk REK NSD Helsedirektoratet Bioteknologinemnda Datatilsynet NEM (Klageorgan)
- 85. Oppsummering ŌĆō hovedpunkter i helseforskningsloven REK f├źr betydelig st├Ėrre ansvar og myndighet, spes. i forh├źndsgodkjenningen Forskningsorganisering blir mer formalisert Forskningsansvarlig Prosjektleder Forskningsprotokoll Samtykkeunntak m├ź lovhjemles Bredt samtykke Bruk av tidligere innsamlede data i helsetjenesten Dataoppbevaring
- 86. Helseforskningsloven tr├źdte i kraft 1 juli 2009 Med Forskrift ŌĆØOm organisering av medisinsk og helsefaglig forskningŌĆØ