Lks konsep mol
- 2. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack SK-KD Indikator Materi Contoh Latihan Referensi Penyusun Judul : Konsep mol Sub pokok bahasan : 1. Mol, jumlah partikel, massa molar, dan volume molar. 2. Kemolaran larutan. Mata pelajaran : kimia kelas X Semester : 1 (satu) Tempat : ruang kelas Alokasi waktu : 2 x 45 menit (1 x pertemuan )
- 3. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack ÔÇßGuru menjelaskan mengenai konsep mol, pengertian mol, hubungan mol dengan jumlah partikel, massa molar dan volum molar gas. ÔÇßGuru menjelaskan mengenai kemolaran larutan, dan memberikan beberapa contoh soal mengenai perhitunan kimia.
- 4. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack Guru membagi siswa menjadi beberapa kelompok untuk mendiskusikan mengenai konsep mol dan menyelesaikan perhitungan kimia Guru memberikan latihan soal untuk dikerjakan dikelas dan tugas dirumah tentang konsep mol dan perhitunan kimia
- 5. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack Siswa mendiskusikan mengenai konsep mol dan menyelesaikan perhitungan kimia. Siswa mengerjakan soal latihan di kelas dan dirumah.
- 6. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack STANDAR KOMPETENSI KOMPETENSI DASAR Memahami hukum-hukum dasar kimia dan penerapannya dalam perhitungankimia Menerapkan konsep mol dalam menyelesaikan perhitungan kimia SK-KD Indikator Materi Contoh Latihan Referensi Penyusun
- 7. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack Menjelaskan pengertian mol sebagai satuan jumlah zat Mengkonversikan jumlah mol dengan jumlah partikel, massa, dan volume zat. SK-KD Indikator Materi Contoh Latihan Referensi Penyusun
- 8. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack SK-KD Indikator Materi Contoh Latihan Referensi Penyusun
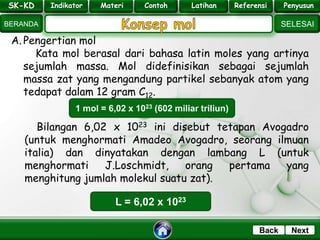
- 9. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack A. Pengertian mol Kata mol berasal dari bahasa latin moles yang artinya sejumlah massa. Mol didefinisikan sebagai sejumlah massa zat yang mengandung partikel sebanyak atom yang tedapat dalam 12 gram C12. 1 mol = 6,02 x 1023 (602 miliar triliun) Bilangan 6,02 x 1023 ini disebut tetapan Avogadro (untuk menghormati Amadeo Avogadro, seorang ilmuan italia) dan dinyatakan dengan lambang L (untuk menghormati J.Loschmidt, orang pertama yang menghitung jumlah molekul suatu zat). L = 6,02 x 1023 SK-KD Indikator Materi Contoh Latihan Referensi Penyusun
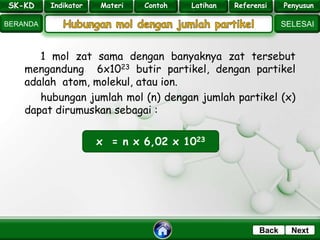
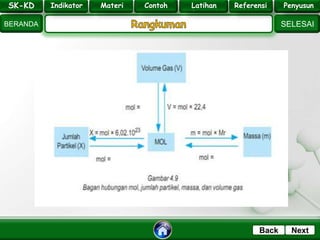
- 10. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack 1 mol zat sama dengan banyaknya zat tersebut mengandung 6x1023 butir partikel, dengan partikel adalah atom, molekul, atau ion. hubungan jumlah mol (n) dengan jumlah partikel (x) dapat dirumuskan sebagai : x = n x 6,02 x 1023 SK-KD Indikator Materi Contoh Latihan Referensi Penyusun
- 11. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack •Menghitung jumlah partikel Tentukan jumlah partikel (atom atau molekul) yang terdapat dalam a. 1 mol Ca b. 2 mol NH3 •penyelesaian x = n x 6,02 x 1023 a. Dalam 1 mol Ca = 1 mol x 6,02x1023 atom/mol = 6,02x1023 atom b. Dalam 2 mol NH3 = 2 mol x 6,02x1023 molekul/mol = 12,04 x 1023 molekul
- 12. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack ÔÅÜ Massa Atom Relatif ( Ar ) adalah perbandingan massa satu atom suatu unsur dengan massa satu atom unsur standar. Contoh : Ar O = 16, Ar Al = 27, Ar Na = 23, Ar Cl = 35,5, Ar C = 12, Ar H = 1Ar Fe = 56 Ar Zn = 65 ÔÅÜ Massa Molekul Relatif ( Mr ) adalah perbandingan massa 1 molekul unsur atau senyawa terhadap 1/12 massa satu atom C-12. Contoh : Mr NaCl = ( 1 X Ar Na ) + ( 1 X Ar Cl ) = ( 1 X 23 ) + ( 1 X 35,5 ) = 23 + 35,5 = 58,5 Mr C2H6O = ( 2 X Ar C ) + ( 6 X Ar H ) + ( 1 X Ar O ) = ( 2 X 12 ) + ( 6 X 1 ) + ( 1 X 16 )= 24 + 6 + 1 6 = 46 SK-KD Indikator Materi Contoh Latihan Referensi Penyusun
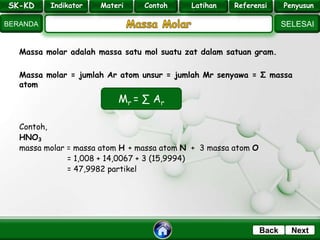
- 13. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack Massa molar adalah massa satu mol suatu zat dalam satuan gram. Massa molar = jumlah Ar atom unsur = jumlah Mr senyawa = Σ massa atom Contoh, HNO3 massa molar = massa atom H + massa atom N + 3 massa atom O = 1,008 + 14,0067 + 3 (15,9994) = 47,9982 partikel Mr = ∑ Ar SK-KD Indikator Materi Contoh Latihan Referensi Penyusun
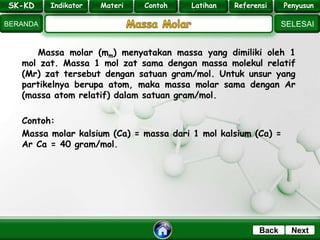
- 14. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack Massa molar (mm) menyatakan massa yang dimiliki oleh 1 mol zat. Massa 1 mol zat sama dengan massa molekul relatif (Mr) zat tersebut dengan satuan gram/mol. Untuk unsur yang partikelnya berupa atom, maka massa molar sama dengan Ar (massa atom relatif) dalam satuan gram/mol. Contoh: Massa molar kalsium (Ca) = massa dari 1 mol kalsium (Ca) = Ar Ca = 40 gram/mol. SK-KD Indikator Materi Contoh Latihan Referensi Penyusun
- 15. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack Hipotesis Avogadro menyebutkan bahwa pada suhu dan tekanan yang sama, semua gas dengan volume yang sama akan mengandung jumlah partikel yang sama pula. Oleh karena 1 mol setiap gas mempunyai jumlah molekul yang sama, maka pada suhu dan tekanan yang sama pula, 1 mol setiap gas mempunyai volume yang sama. Volume per mol gas disebut volume molar dan dilambangkan Vm. Jadi, pada suhu dan tekanan yang sama, volume gas hanya bergantung pada jumlah molnya. V = n x Vm SK-KD Indikator Materi Contoh Latihan Referensi Penyusun
- 16. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack Volum molar gas bergantung pada suhu dan tekanan. Berikut empat kondisi penentuan volum gas: a. Keadaan standar (STP) kondisi dengan suhu 0o C dan tekanan 1 atm, disebut keadaan standar dan dinyatakan dengan STP (standar Temperature and Pressure). Pada keadaan STP, volume molar gas adalah 22,4 liter mol-1 b. Keadaan kamar (RTP) kondisi dengan suhu 25o C dan tekanan 1 atm disebut keadaan kamar dan dinyatakan dengan RTP (Room Temperature and pressure). Volume molar gas pada keadaan RTP adalah 24 liter mol-1 Pada keadaan STP : Vm = 22,4 liter mol-1 Pada keadaan RTP : Vm = 24 liter mol-1 SK-KD Indikator Materi Contoh Latihan Referensi Penyusun
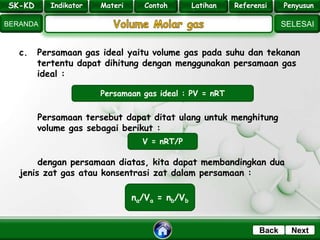
- 17. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack c. Persamaan gas ideal yaitu volume gas pada suhu dan tekanan tertentu dapat dihitung dengan menggunakan persamaan gas ideal : Persamaan tersebut dapat ditat ulang untuk menghitung volume gas sebagai berikut : dengan persamaan diatas, kita dapat membandingkan dua jenis zat gas atau konsentrasi zat dalam persamaan : Persamaan gas ideal : PV = nRT V = nRT/P na/Va = nb/Vb SK-KD Indikator Materi Contoh Latihan Referensi Penyusun
- 18. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack •Menentukan volume molar berapa liter volume dari 3,4 gram gas NH3 (Ar N = 14; Ar H = 1) bila diukur pada a. Keadaan standar (STP) b. Keadaan kamar (RTP) c. Pada 27oC dan tekanan 1 atm •Penyelesaian mol = massa / Mr = 3,4 / 17 = 0,2 mol a. Volume dari 0,2 mol NH3 , V = n x Vm ; = 0,2 mol x 22,4 Lmol-1 = 4,48 L SK-KD Indikator Materi Contoh Latihan Referensi Penyusun
- 19. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack b. Pada keadaan kamar (RTP), Vm = 24 Lmol-1 Volume dari 0,2 mol NH3 V = n x Vm 0,2 mol x 24 Lmol-1 = 4,8 L c. Volume gas pada 27oC, 1 atmm dihitung dengan rumus : PV = nRT atau V = nRT/P T = 27 + 273 =300 K V = nRT/P = 0,2 mol x 0,082 Latmmol-1K-1 x 300 K / 1 atm = 3,075 L SK-KD Indikator Materi Contoh Latihan Referensi Penyusun
- 20. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack Molaritas (M) atau kemolaran adalah salah satu cara menyatakan konsentrasi atau kepekatan larutan. Molaritas menyatakan jumlah mol zat terlarut dalam tiap liter larutan. Satuan molaritas (M) adalah mol/liter atau mmol/mL. sementara itu, campuran homogen dua jenis atau lebih zat disebut larutan. Maka dapat dituliskan persamaan molaritas larutan sebagai berikut: salah satu keuntunga yang diperoleh jika konsentrasi larutan dinyatakan dalam kemolaran adlah kemudahan untuk mengetahui jumlah mol zat terlarut dalam volume tertentu larutan. Maka disusun ulang : SK-KD Indikator Materi Contoh Latihan Referensi Penyusun
- 21. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack SK-KD Indikator Materi Contoh Latihan Referensi Penyusun
- 22. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack •Menentukan massa molar Tentukan massa molar senyawa dibawah ini jika diketahui : Ar K = 39; Ar Cl =35,5 ; Ar Na = 23 ; Ar S = 32 ; Ar O = 16;Ar Cr = 52 a. KCl b. Na2S2O3 SK-KD Indikator Materi Contoh Latihan Referensi Penyusun •Penyelesaian a. Mr KCl = Ar K + Ar Cl = 39 + 35,5 =74,5 gram /mol b. Mr Na2S2O3 = (2 x Ar Na) + ( 2 x Ar S) + ( 3 x Ar O ) = (2 x 23) + ( 2 x 32 ) + ( 3 x 16 ) = 158 gram / mol
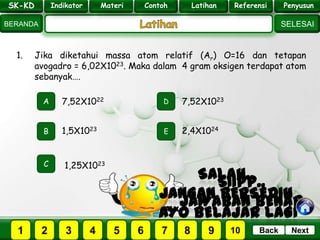
- 23. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack 1. Jika diketahui massa atom relatif (Ar) O=16 dan tetapan avogadro = 6,02X1023. Maka dalam 4 gram oksigen terdapat atom sebanyak…. A B E D C 1,5X1023 7,52X1022 7,52X1023 2,4X1024 1,25X1023 PILIH SOAL : 2 3 41 5 6 7 SK-KD Indikator Materi Contoh Latihan Referensi Penyusun 8 9 10
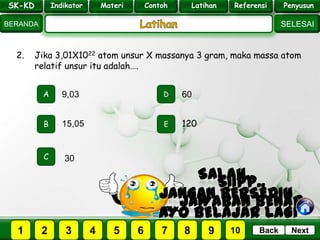
- 24. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack 2. Jika 3,01X1022 atom unsur X massanya 3 gram, maka massa atom relatif unsur itu adalah…. A B E D C 15,05 9,03 60 120 30 PILIH SOAL : SK-KD Indikator Materi Contoh Latihan Referensi Penyusun 2 3 41 5 6 7 8 9 10
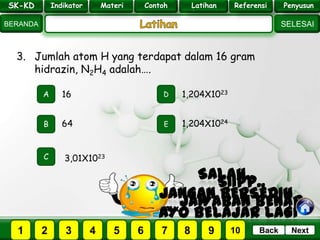
- 25. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack 3. Jumlah atom H yang terdapat dalam 16 gram hidrazin, N2H4 adalah…. A B E D C 64 16 1,204X1023 1,204X1024 3,01X1023 PILIH SOAL : SK-KD Indikator Materi Contoh Latihan Referensi Penyusun 2 3 41 5 6 7 8 9 10
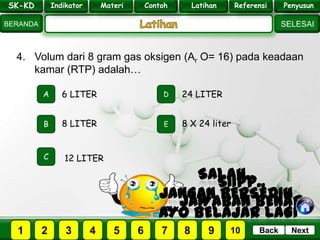
- 26. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack 4. Volum dari 8 gram gas oksigen (Ar O= 16) pada keadaan kamar (RTP) adalah… A B E D C 8 LITER 6 LITER 24 LITER 8 X 24 liter 12 LITER PILIH SOAL : SK-KD Indikator Materi Contoh Latihan Referensi Penyusun 2 3 41 5 6 7 8 9 10
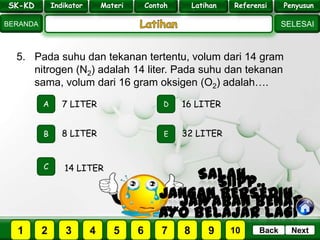
- 27. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack 5. Pada suhu dan tekanan tertentu, volum dari 14 gram nitrogen (N2) adalah 14 liter. Pada suhu dan tekanan sama, volum dari 16 gram oksigen (O2) adalah…. A B E D C 8 LITER 7 LITER 16 LITER 32 LITER 14 LITER PILIH SOAL : SK-KD Indikator Materi Contoh Latihan Referensi Penyusun 2 3 41 5 6 7 8 9 10
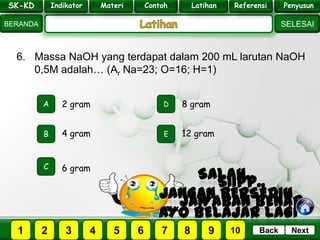
- 28. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack 6. Massa NaOH yang terdapat dalam 200 mL larutan NaOH 0,5M adalah… (Ar Na=23; O=16; H=1) A B E D C 4 gram 2 gram 8 gram 12 gram 6 gram PILIH SOAL : SK-KD Indikator Materi Contoh Latihan Referensi Penyusun 2 3 41 5 6 7 8 9 10
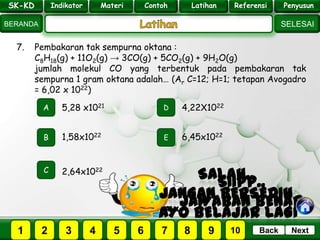
- 29. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack 7. Pembakaran tak sempurna oktana : C8H18(g) + 11O2(g) → 3CO(g) + 5CO2(g) + 9H2O(g) jumlah molekul CO yang terbentuk pada pembakaran tak sempurna 1 gram oktana adalah… (Ar C=12; H=1; tetapan Avogadro = 6,02 x 1022) A B E D C 1,58x1022 5,28 x1021 4,22X1022 6,45x1022 2,64x1022 PILIH SOAL : SK-KD Indikator Materi Contoh Latihan Referensi Penyusun 2 3 41 5 6 7 8 9 10
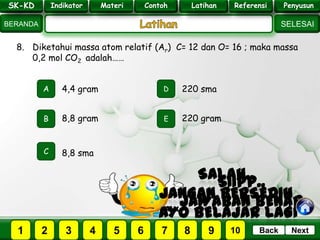
- 30. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack SK-KD Indikator Materi Contoh Latihan Referensi Penyusun 8. Diketahui massa atom relatif (Ar) C= 12 dan O= 16 ; maka massa 0,2 mol CO2 adalah…… A B E D C 8,8 gram 4,4 gram 220 sma 220 gram 8,8 sma PILIH SOAL : SK-KD Indikator Materi Contoh Latihan Referensi Penyusun 2 3 41 5 6 7 8 9 10
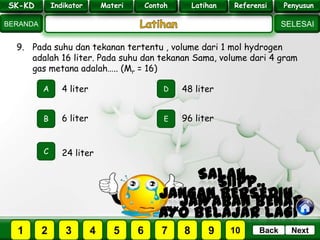
- 31. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack SK-KD Indikator Materi Contoh Latihan Referensi Penyusun 9. Pada suhu dan tekanan tertentu , volume dari 1 mol hydrogen adalah 16 liter. Pada suhu dan tekanan Sama, volume dari 4 gram gas metana adalah….. (Mr = 16) A B E D C 6 liter 4 liter 48 liter 96 liter 24 liter PILIH SOAL : SK-KD Indikator Materi Contoh Latihan Referensi Penyusun 2 3 41 5 6 7 8 9 10
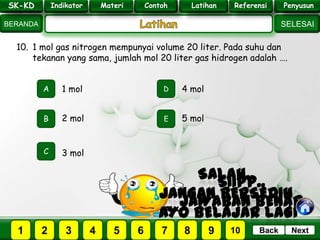
- 32. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack SK-KD Indikator Materi Contoh Latihan Referensi Penyusun 10. 1 mol gas nitrogen mempunyai volume 20 liter. Pada suhu dan tekanan yang sama, jumlah mol 20 liter gas hidrogen adalah …. A B E D C 2 mol 1 mol 4 mol 5 mol 3 mol PILIH SOAL : SK-KD Indikator Materi Contoh Latihan Referensi Penyusun 2 3 41 5 6 7 8 9 10
- 33. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack KONSEP MOL INFORMASI 1. Konsep mol adalah besaran yang digunakan dalam perhitungan kimia 2. 1 mol zat adalah banyaknya sekian gram zat yang mengandung 6,02 . 1023 partikel Misal: 1 mol Fe = 6,02 . 1023 atom-atom besi Massa 1 mol Fe = Ar Fe = 56 gram massa molar Fe = 56 gr/mol mm Fe = 56 gr/mol 1 mol CO2 = 6,02 . 1023 molekul-molekul CO2 Massa 1 mol CO2 = Mr CO2 = 44 gr Massa molarCO2 = 44 gr/mol mm CO2 = 44 g/mol SK-KD Indikator Materi Contoh Latihan Referensi PenyusunSK-KD Indikator Materi Contoh Latihan Referensi Penyusun
- 34. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack Pertanyaan: 1. Berapa mm Na = ................ Berapa mm NH3 = ................ Berapa mm H2SO4 = ................ Massa 1 mol SO3 = ................ Massa 2 mol SO3 = ................ 2. Jumlah atom dalam 1 mol oksigen = ................ Jumlah atom atom dalam 5 mol karbon = ................ Jumlah molekul dalam 1 mol NH3 = ................ Jumlah molekul dalam 2 mol CH4 = ................ SK-KD Indikator Materi Contoh Latihan Referensi PenyusunSK-KD Indikator Materi Contoh Latihan Referensi Penyusun
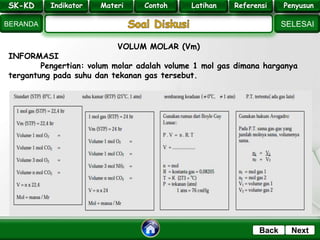
- 35. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack VOLUM MOLAR (Vm) INFORMASI Pengertian: volum molar adalah volume 1 mol gas dimana harganya tergantung pada suhu dan tekanan gas tersebut. SK-KD Indikator Materi Contoh Latihan Referensi PenyusunSK-KD Indikator Materi Contoh Latihan Referensi Penyusun
- 36. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack Pertanyaan : 1. Hitung volume 0,2 mol gas CH4 yang diukur pada : a. keadaan STP (0oC, 76 cmHg) b. keadaan RTP (25oC, 1 atm) c. pada suhu 30 oC, 1 atm d. pada P.T dimana 0,1 mol gas O2 = 10 ltr 2. Hitung volume 8,8 gram CO2 a. pada keadaan STP b. pada RTP c. pada suhu 27 oC tekanan 1 atm d. pada P.T dimana 1 ltr gas CH4 = 3,2 gram SK-KD Indikator Materi Contoh Latihan Referensi PenyusunSK-KD Indikator Materi Contoh Latihan Referensi Penyusun
- 37. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack KEMOLARAN LARUTAN INFORMASI Kemolaran (M) adalah banyaknya mol zat terlarut dalam setiap liter larutan. M = n/V n = mol V = liter “Ayo Berfikir. . . .!!!!” 1. 4 gram kristal NaOH (Mr = 40) dicampur dengan air hingga volume tepat 500 ml. Coba tentukan kemolaran larutan yang terjadi? 2. Berapa molekul yang terdapat dalam 20 gram NaOH ? 3. Diketahui reaksi : CaCO3 (s) + 2HCl (aq) → CaCl2 (aq) + H2O (l) + CO2 (g) Jika 5 gram batu kapur direaksikan dengan asam klorida encer, maka pada keadaan STP akan diperoleh sebanyak… (Ar : Ca = 40 , Cl = 35,5 , O = 16 , C = 12 dan H = 1) SK-KD Indikator Materi Contoh Latihan Referensi PenyusunSK-KD Indikator Materi Contoh Latihan Referensi Penyusun
- 38. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack 1. Jika ada suatu sampel mengandung 3 mol besi (Fe). Berapakah jumlah partikelnya dalam sampel tersebut…… 2. Tentukan massa molar senyawa Na2S2O3, jika diketahui Ar Na = 23 ; Ar S = 32 ; Ar O = 16! 3. Hitunglah jumlah mol dari 35,1 gram NaCl (Ar Na = 23 dan Cl = 35,5)! 4. Berapakah volum dari 0,2 mol karbon dioksida jika diukur pada: a. Keadaan standar (STP) b. Keadaan kamar (RTP) c. 270C, 1 atm d. T, P tertentu di mana 1 mol oksigen = 25 L? 5. Hitunglah jumlah mol dan massa urea (Mr= 60) yang terdapat dalam 200 mL larutan urea 0,4 M! SK-KD Indikator Materi Contoh Latihan Referensi PenyusunSK-KD Indikator Materi Contoh Latihan Referensi Penyusun
- 39. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack SK-KD Indikator Materi Contoh Latihan Referensi PenyusunSK-KD Indikator Materi Contoh Latihan Referensi Penyusun
- 40. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack • Petrucci, Ralph. H, 1992. Kimia Dasar, Prinsip dan Terapan Modern. Terjemahan Suminar. Jakarta: Erlangga • Brady, James E. dan J.R. Holum. 1988. Fundamentals of Chemistry. Edisi 3, New York: Jon Willey & Sons, Inc. • Parning, Horale, Tiopan, 2006, Kimia SMA Kelas XI Semester I, Jakarta: Yudistira • Purba, Michael. 2006. Kimia Jilid 2 untuk SMA kelas XI. Jakarta : Erlangga SK-KD Indikator Materi Contoh Latihan Referensi Penyusun
- 41. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack SK-KD Indikator Materi Contoh Latihan Referensi Penyusun Disusun oleh :
- 42. SK - KD SELESAI Indikator BERANDA PenyusunReferensiUji KompLatihanMateri NextBack M h SK-KD Indikator Materi Contoh Latihan Referensi Penyusun